题目内容
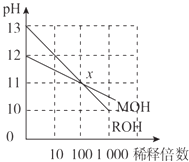
【题目】某固体混合物可能含Al、(NH4)2SO4、MgCl2、AlCl3、FeCl3中的一种或几种,现对该混合物作如下实验,所得现象和有关数据如下图(气体体积已换算成标准状况下的体积).下列叙述不正确的是( )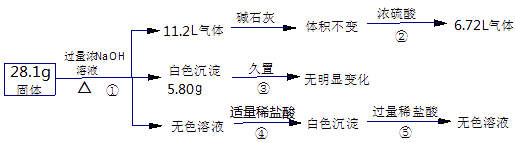
A.该实验的整个过程共涉及6个化学反应
B.该实验的整个过程只涉及1个氧化还原反应
C.混合物中一定有Al、(NH4)2SO4、MgCl2 , 一定没有AlCl3、FeCl3
D.混合物中一定有Al、(NH4)2SO4、MgCl2、AlCl3 , 一定没有FeCl3
【答案】D
【解析】解:根据生成气体通过碱石灰体积不变(无酸性气体),而通过浓硫酸体积减小,说明剩余的 6.72 L气体为氢气,即原固体中一定含有金属Al,且其质量为 ![]() ×27 g/mol=5.4 g.生成氨气的物质的量为
×27 g/mol=5.4 g.生成氨气的物质的量为 ![]() =0.2 mol,则原固体中一定含有 0.1 mol (NH4)2SO4 , 其质量为13.2 g,得到白色沉淀久置不变色,说明无FeCl3 , 因为NaOH过量,所以白色沉淀不可能含有氢氧化铝,则说明5.8 g白色沉淀为Mg(OH)2 , 为0.1 mol,则固体中MgCl2为0.1 mol,质量为9.5g,无色溶液中有Al与过量NaOH溶液反应后得到的NaAlO2 , Al、(NH4)2SO4、MgCl2的总质量为:5.4g+13.2g+9.5g=28.1 g,等于原固体的质量,说明混合物中不含有AlCl3 ,
=0.2 mol,则原固体中一定含有 0.1 mol (NH4)2SO4 , 其质量为13.2 g,得到白色沉淀久置不变色,说明无FeCl3 , 因为NaOH过量,所以白色沉淀不可能含有氢氧化铝,则说明5.8 g白色沉淀为Mg(OH)2 , 为0.1 mol,则固体中MgCl2为0.1 mol,质量为9.5g,无色溶液中有Al与过量NaOH溶液反应后得到的NaAlO2 , Al、(NH4)2SO4、MgCl2的总质量为:5.4g+13.2g+9.5g=28.1 g,等于原固体的质量,说明混合物中不含有AlCl3 ,
A.过程中涉及的反应为:Al、(NH4)2SO4、MgCl2分别与NaOH的反应,NH3与硫酸的反应,NaAlO2与盐酸的反应,Al(OH)3与盐酸的反应,共6个反应,故A正确;
B.Al与NaOH反应为氧化还原反应,故B正确;
C.有以上分析可知,混合物中一定有Al、(NH4)2SO4、MgCl2 , 一定没有AlCl3、FeCl3 , 故C正确;
D.由以上分析可知不含AlCl3 , 故D错误.
故选D.