题目内容
【题目】常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( ) 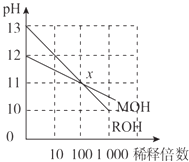
A.ROH是一种强碱,MOH是一种弱碱
B.等浓度的MOH与盐酸反应,所得溶液呈中性,则V(MOH)>V(盐酸)
C.在x点,c(M+)=c(R+)
D.稀释前,c(ROH)=10c(MOH)
【答案】D
【解析】解:A.ROH开始的pH=13,稀释100倍pH=11,则ROH为强碱,MOH开始的pH=12,稀释100倍pH=11,则MOH为弱碱,故A正确;B.MOH为弱碱,等物质的量浓度的MOH与盐酸反应,假设等体积的两种物质反应,则所得溶液呈酸性,要使所得溶液呈中性,则碱应该稍微过量,所以碱的体积应该大于酸,故B正确;
C.由ROH═R++OH﹣ , MOHM++OH﹣可知,在x点,c(OH﹣)相等,则c(M+)=c(R+),故C正确;
D.稀释前,c(ROH)=0.1mol/L,c(MOH)>0.01mol/L,则c(ROH)<10c(MOH),故D错误;
故选D.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目