题目内容
17.已知Co2(OH)2CO3和Li2CO3在空气中保持温度为600~800℃,可制得LiCoO2,已知3Co2(OH)2CO3+O2→2Co3O4+3H2O+3CO2;4Co3O4+6Li2CO3+O2→12LiCoO2+6CO2.按钴和锂的原子比1:1混合固体,空气过量70%,800℃时充分反应,计算产物气体中CO2的体积分数(保留三位小数,已知空气组成,N2体积分数0.79,O2体积分数0.21)分析 由3Co2(OH)2CO3+O2→2Co3O4+3H2O+3CO2;4Co3O4+6Li2CO3+O2→12LiCoO2+6CO2
可得方程式:6Co2(OH)2CO3+6Li2CO3+3O2$\frac{\underline{\;600~800℃\;}}{\;}$12LiCoO2+6H2O+12CO2;
令参加反应的氧气为3mol,则相当于$\frac{3}{0.21}$mol空气,空气过量70%,则空气通入(1+0.7)×$\frac{3}{0.21}$mol,生成6mol水(g)和12mol CO2,据此计算CO2的体积分数.
解答 解:由3Co2(OH)2CO3+O2→2Co3O4+3H2O+3CO2;4Co3O4+6Li2CO3+O2→12LiCoO2+6CO2
可得方程式:6Co2(OH)2CO3+6Li2CO3+3O2$\frac{\underline{\;600~800℃\;}}{\;}$12LiCoO2+6H2O+12CO2;
令参加反应的氧气为3mol,则相当于$\frac{3}{0.21}$mol空气,空气过量70%,则空气通入(1+0.7)×$\frac{3}{0.21}$mol,生成6mol水(g)和12mol CO2;
所以产物气体中CO2的体积分数=$\frac{12mol}{(12+6-3+1.7×\frac{3}{0.21})mol}$=0.305;
答:产物气体中CO2的体积分数为0.305.
点评 本题考查了有关化学方程式的计算,题目难度较大,侧重于考查学生的分析能力和计算能力,注意根据方程式中物质之间的物质的量的关系计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列各化合物的命名正确的是( )
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | B. |  3-丁醇 3-丁醇 | ||
| C. | 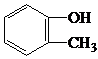 甲基苯酚 甲基苯酚 | D. | 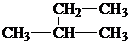 2-甲基丁烷 2-甲基丁烷 |
8.下列不正确的是( )
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 非金属性:F>O>S |
5.下列各组粒子能在指定溶液中大量共存的是( )
| A. | 银氨溶液中:Na+,H+,NO3- | B. | 碘化钾溶液中:H+,H2O,SO32- | ||
| C. | 偏铝酸钠溶液中:K+,Cl-,SO42- | D. | 氢氧化钙溶液中:Na+,ClO-,HCO3- |
12.下列图示与对应的叙述一定正确的是( )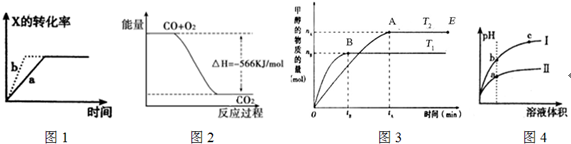

| A. | 图1所示,反应X(g)+2Y(g)═3Z(g),b的压强一定比a大 | |
| B. | 图2表示CO生成CO2的反应过程和能量关系 | |
| C. | 图3表示反应CO+2H2═CH3OH,其中温度T1>T2,在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的$\frac{1}{2}$,平衡正向移动,氢气浓度增大 | |
| D. | 图4所示,用水稀释pH相同的盐酸和醋酸,I表示盐酸,II表示醋酸,且溶液导电性c>b>a |
2.提出了核外电子分层排布的原子结构模型的科学家是( )
| A. | 卢瑟福 | B. | 玻尔 | C. | 汤姆逊 | D. | 道尔顿 |
6.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色.
(1)B元素在元素周期表中的位置第三周期第ⅢA族B形成的简单离子的结构示意图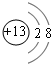 .
.
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是H2SO4.
(3)用电子式表示C、H形成化合物的过程: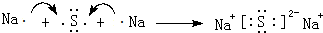 .
.
(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为离子键和非极性键.
(5)G的最高价与E形成的化合物的电子式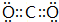 ,该分子的结构式为O=C=O.
,该分子的结构式为O=C=O.
(6)A、B、C、E原子半径由大到小的顺序为Mg>Al>S>O.
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)B元素在元素周期表中的位置第三周期第ⅢA族B形成的简单离子的结构示意图
 .
.(2)上述元素的最高价氧化物对应的水化物中酸性最强的是H2SO4.
(3)用电子式表示C、H形成化合物的过程:
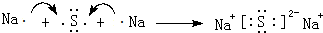 .
.(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为离子键和非极性键.
(5)G的最高价与E形成的化合物的电子式
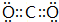 ,该分子的结构式为O=C=O.
,该分子的结构式为O=C=O.(6)A、B、C、E原子半径由大到小的顺序为Mg>Al>S>O.
7.下列物质注入水中,振荡后静置,能分层浮于水面的是( )
①溴苯 ②乙酸乙酯 ③乙醇 ④硝基苯 ⑤CCl4 ⑥苯.
①溴苯 ②乙酸乙酯 ③乙醇 ④硝基苯 ⑤CCl4 ⑥苯.
| A. | ①②③ | B. | ①②③⑥ | C. | ②③⑥ | D. | ②⑥ |