题目内容
下列说法正确的是 ( )
| A.H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键。 |
| B.HF、HCl、HBr、HI的熔点沸点依次升高。 |
| C.乙醇分子与水分子之间只存在范德华力。 |
| D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4 |
A
解析试题分析:A.H2O、H2S都是氧族元素形成的氢化物,结构相似,但是由于O元素的电负性大,原子半径小,所以在分子之间除了存在分子间作用力外,还存在氢键。增加了分子之间的相互作用,使得其熔沸点比与它相对分子质量大的H2S还高。正确。B.HF、HCl、HBr、HI也都是同族元素形成的氢化物。结构相似。一般情况下,结构相似的物质,相对分子质量越大,分子间的作用力就越大,物质的的熔点沸点就越高。但是由于F元素的电负性大,原子半径小,所以在分子之间除了存在分子间作用力外,还存在氢键。增加了分子之间的相互作用,使得其熔沸点要高很多。错误。C.乙醇分子与水分子之间除了存在范德华力外还存在氢键。错误。D.对同种元素形成的有氧酸之间的比较规律就是高价态的酸酸性强于低价态的酸的酸性。所以氯的各种含氧酸的酸性由强到弱排列为:HClO4> HClO3> HClO2>HClO。错误。
考点:考查物质的熔沸点与氢键的关系及同种元素形成的各种不同价态的含氧酸的酸性强弱的比较的知识。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案CO2的的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应:NH3+CO2→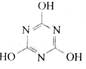 +H2O
+H2O
下列有关三聚氰胺的说法正确的是
| A.分子式为C3H6N3O3 | B.分子中既含极性键,又含非极性键 |
| C.属于共价化合物 | D.生成该物质的上述反应为中和反应 |
下列图像表达正确的是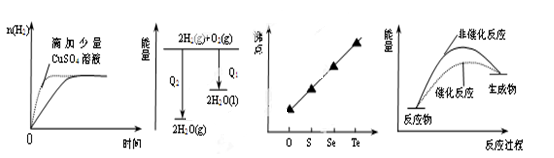
| A.等质量锌粉与足量盐酸反应 |
| B.氢气与氧气反应中的能量变化 |
| C.气态氢化物沸点 |
| D.催化反应与非催化反应过程中的能量关系 |
下列物质中不存在氢键的是
| A.水 | B.甲醇 | C.乙醇 | D.乙烷 |
在化学上,常用一条短线表示一个化学键,如下图所示的有关结构中,有直线(包括虚线)不表示化学键或分子间作用力的是( )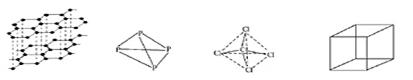
| A.石墨的结构 | B.白磷的结构 | C.CCl4的结构 | D.立方烷(C8H8)的结构 |
下列说法正确的是( )
| A.含有共价键的化合物一定是共价化合物 |
| B.分子中只有共价键的化合物一定是共价化合物 |
| C.由共价键形成的一定是共价化合物分子 |
| D.只有非金属原子间才能形成共价键 |
下列过程中,共价键被破坏的是( )
| A.碘升华 |
| B.二氧化氮被木炭吸附 |
| C.酒精溶于水 |
| D.HCl气体溶于水 |
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的电子层结构,
电子式如图所示: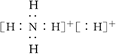 ,下列说法正确的是( )
,下列说法正确的是( )
| A.NH5属于离子化合物 |
| B.NH5属于共价化合物 |
| C.NH5只含有离子键 |
| D.NH5只含有共价键 |
离子键的强弱主要决定于离子的半径和离子电荷数。一般规律是:离子半径越小,离子电荷数越大,则离子键越强。K2O、MgO、CaO三种物质中离子键由强到弱的顺序是( )
| A.K2O、MgO、CaO | B.MgO、K2O、CaO |
| C.MgO、CaO、K2O | D.CaO、MgO、K2O |