题目内容
CO2的的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应:NH3+CO2→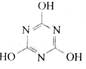 +H2O
+H2O
下列有关三聚氰胺的说法正确的是
| A.分子式为C3H6N3O3 | B.分子中既含极性键,又含非极性键 |
| C.属于共价化合物 | D.生成该物质的上述反应为中和反应 |
C
解析试题分析:A、分子式为C3H3N3O3,错误;B、该分子中没有非极性键,错误;C、正确;D、该反应不是中和反应,中和反应是酸碱反应。
考点:化学与STS、基本概念、物质结构

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列物质中,只含有极性键的是( )
| A.NaOH | B.Na2O2 | C.H2O2 | D.HClO |
下列物质中既含有共价键又含有离子键的是
| A.C2H2 | B.Na2O | C.KOH | D.HClO |
下列物质既含有离子键又含有共价键的是
| A.H2O | B.Na2O | C.NH4Cl | D.N2 |
下列说法错误的是
| A.对羟基苯甲酸的沸点比邻羟基苯甲酸高,冰中既存在范德华力,又存在氢键 |
| B.简单立方是非密置层三维堆积形成的,面心立方是由密置层三维堆积形成的 |
| C.所有共价键都有方向性,形成氢键的三个相关原子可以不在直线上 |
| D.金属晶体的导电、导热性都与自由电子有关,离子晶体在一定条件下可以导电 |
下列说法正确的是 ( )
| A.由分子组成的物质中一定存在共价键 |
| B.由非金属元素组成的化合物一定是共价化合物 |
| C.非极性键只存在双原子分子中 |
| D.两个非金属元素原子间不可能形成离子键 |
下列物质中,化学键类型完全相同的是
| A.CaBr2与HCl | B.MgCl2与Na2S |
| C.KOH与NaCl | D.H2O与NaCl |
下列说法正确的是 ( )
| A.H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键。 |
| B.HF、HCl、HBr、HI的熔点沸点依次升高。 |
| C.乙醇分子与水分子之间只存在范德华力。 |
| D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4 |
下列现象不能用氢键解释的是
| A.冰的密度比水小,浮于水面 | B.氨气易液化 |
| C.乙醇极易溶于水 | D.碘易溶于苯(C6H6) |