题目内容
【题目】FeCl3为黑棕色固体,无水氯化铁在300℃以上升华,遇潮湿空气极易潮解。
(1)甲组同学拟用下列装置制取纯净干燥的氯气。
①装置B的作用是_________
②装置A中发生反应时消耗的氧化剂和还原剂的物质的量之比为__________
(2)乙组同学选用甲组实验中的装置ABC和下列装置制取FeCl3
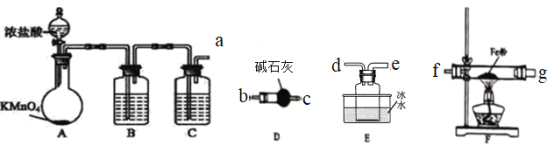
①乙组同学的实验装置中,依次连接的合理顺序为:a→_____→_____→_____→_____→_____→_____
②连好装置,检查装置的气密性,先打开装置A中___________(填仪器的名称)的活塞,直到______再点燃装置F处的酒精灯,目的是_______
③装置D的作用有_______
(3)实验结束后,取少量F中的固体加水溶解,欲对所得产物FeCl3中是否含有FeCl2进行检测,所需试剂是_______
a.KSCN b.H2O2 c.K3[Fe(CN)6] d. .K4[Fe(CN)6]
经检测发现溶液中含有Fe2+,丙同学认为所得产物FeCl3中一定含有FeCl2,丁同学认为不一定,理由是_____
【答案】吸收多余的HCl 1:5 f g d e b c 分液漏斗 装置中充满黄绿色的气体 排尽装置内的空气 吸收多余的氯气和防止空气中的水蒸气进入装置 c FeCl3与过量的铁粉反应生成FeCl2,所以不一定含有FeCl2
【解析】
(1)①制取的氯气中混有HCl和水蒸气,先通入饱和食盐水中除去氯化氢,再通入浓硫酸吸收水蒸气,则装置B应盛放饱和食盐水,吸收多余的HCl;
②该实验用KMnO4与浓盐酸反应制取氯气,写出反应的离子方程式,从而判断氧化剂和还原剂的物质的量之比;
(2)①利用装置ABC可以制取干燥纯净的氯气,氯气通入F装置中与铁粉加热反应生成氯化铁,再连接E装置,冰水浴收集升华的氯化铁,再连接D装置,碱石灰吸收多余的氯气,并阻止空气中的水蒸气进入E装置,据此将导管口进行连接;
②连好装置,检查装置的气密性,先打开装置A中分液漏斗的活塞,KMnO4与浓盐酸开始反应生成氯气,用氯气排尽装置内的空气,防止铁与氧气反应,直到装置中充满黄绿色的气体,再点燃装置F处的酒精灯;
③根据已知信息无水氯化铁遇潮湿空气极易潮解,并防止多余氯气进入空气从而分析装置D的作用;
(3)根据亚铁离子的检验选择试剂;根据FeCl3与铁粉可反应生成FeCl2分析原因。
(1)①制取的氯气中混有HCl和水蒸气,先通入饱和食盐水中除去氯化氢,再通入浓硫酸吸收水蒸气,则装置B应盛放饱和食盐水,吸收吸收多余的HCl;
故答案为:吸收多余的HCl;
②该实验用KMnO4与浓盐酸反应制取氯气,装置A中发生反应的离子方程式为:2MnO4-+10Cl- +16H+=2Mn2++5Cl2↑+8H2O,KMnO4为氧化剂,Cl- 为还原剂,则消耗的氧化剂和还原剂的物质的量之比为1:5;
故答案为:1:5;
(2)①利用装置ABC可以制取干燥纯净的氯气,氯气通入F装置中与铁粉加热反应生成氯化铁,再连接E装置,冰水浴收集升华的氯化铁,再连接D装置,碱石灰吸收多余的氯气,并阻止空气中的水蒸气进入E装置,则导管口依次连接的合理顺序为:a→f→g→d→e→b→c;
故答案为:f;g;d;e;b;c;
②连好装置,检查装置的气密性,先打开装置A中分液漏斗的活塞,KMnO4与浓盐酸开始反应生成氯气,用氯气排尽装置内的空气,防止铁与氧气反应,直到装置中充满黄绿色的气体,再点燃装置F处的酒精灯;
故答案为:分液漏斗;装置中充满黄绿色的气体;排尽装置内的空气;
③装置D盛放碱石灰,可用于吸收多余的氯气和防止空气中的水蒸气进入装置,防止FeCl3潮解;
故答案为:吸收多余的氯气和防止空气中的水蒸气进入装置;
(3)FeCl3、FeCl2同时存在时,检验Fe2+用K3[Fe(CN)6]溶液,现象为有蓝色沉淀生成;
由于FeCl3与过量的铁粉反应生成FeCl2,所以不一定含有FeCl2;
故答案为:c;FeCl3与过量的铁粉反应生成FeCl2,所以不一定含有FeCl2。