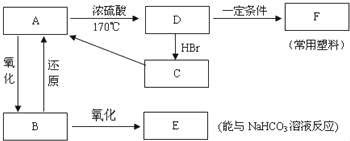
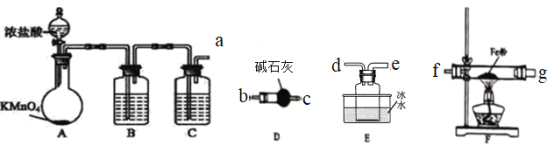
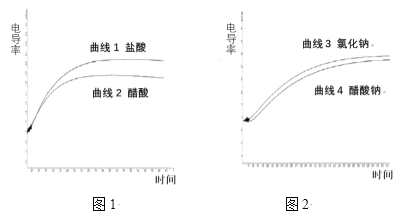
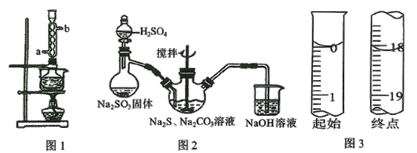
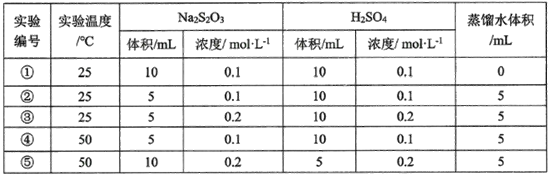
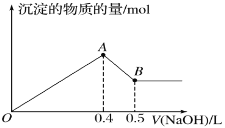
题目内容
【题目】(1)某气态氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL则该R摩尔质量为___。
(2)已知CO、SO2的混合气体质量共18.4g,标准状况下体积为8.96L,则可推知该混合气体中CO的物质的量分数为____,混合气体的平均相对分子质量为____。
(3)同温同压下,SO2与氢气的密度之比为____;若体积相同时,两种气体的质量比为____。
(4)质量比为51∶28的NH3、CO所含质子数之比为____。
(5)标准状况下,aL气体X2和bL气体Y2恰好完全反应生成cL气体Z,若2a=6b=3c,则Z的化学式为____。
【答案】32g/mol 50% 46 32∶1 32∶1 15∶7 X3Y或YX3
【解析】
(1)根据n=![]() 计算RO2的物质的量,再根据M=
计算RO2的物质的量,再根据M=![]() 计算RO2的摩尔质量,进而计算R的摩尔质量;
计算RO2的摩尔质量,进而计算R的摩尔质量;
(2)根据n=![]() 计算混合气体的物质的量总量,根据二者总质量、总物质的量列方程计算;根据
计算混合气体的物质的量总量,根据二者总质量、总物质的量列方程计算;根据![]() =
=![]() 计算平均相对分子质量;
计算平均相对分子质量;
(3)同温同压下,气体的密度之比等于其相对分子质量之比;同温同压下,SO2与氢气的体积相等,质量之比等于其密度之比;
(4)根据n=![]() 计算物质的量之比,结合每个分子含有质子数计算;
计算物质的量之比,结合每个分子含有质子数计算;
(5)气体体积之比等于其化学计量数之比,再根据原子守恒计算确定Z的化学式。
(1)RO2的物质的量为![]() =0.02mol,故RO2的摩尔质量为
=0.02mol,故RO2的摩尔质量为![]() =64g/mol,则R摩尔质量为64g/mol-2×16g/mol=32g/mol,故答案为:32g/mol;
=64g/mol,则R摩尔质量为64g/mol-2×16g/mol=32g/mol,故答案为:32g/mol;
(2)CO、SO2的混合气体物质的量总量为:![]() =0.4mol,设CO、SO2的物质的量分别为xmol、ymol,则:x+y=0.4,28x+64y=18.4,解得x=0.2,y=0.2;该混合气体中CO的物质的量分数为
=0.4mol,设CO、SO2的物质的量分别为xmol、ymol,则:x+y=0.4,28x+64y=18.4,解得x=0.2,y=0.2;该混合气体中CO的物质的量分数为![]() ×100%=50%,混合气体的平均相对分子质量为:
×100%=50%,混合气体的平均相对分子质量为:![]() =46,故答案为:50%;46;
=46,故答案为:50%;46;
(3)同温同压下,SO2与氢气的密度之比=相对分子质量之比=64∶2=32∶1;若体积相同时,质量之比等于其密度之比,则两种气体的质量比为32∶1,故答案为:32∶1;32∶1;
(4)质量比为51∶28的NH3、CO所含质子数之比为![]() ×10∶
×10∶![]() ×14=15∶7,故答案为:15∶7;
×14=15∶7,故答案为:15∶7;
(5)该反应的方程式可以表示为:aX2+bY2=cZ,若2a=6b=3c,则a∶b∶c=3∶1∶2,由原子守恒可知Z的化学式为X3Y或YX3,故答案为:X3Y或YX3。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案