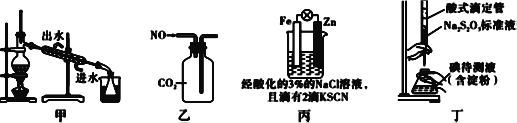
题目内容
【题目】化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
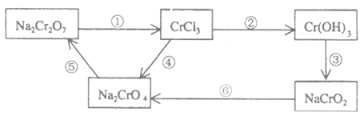
(1)配平并回答问题,用单线桥标出2个反应的电子转移的方向和数目。
反应①为:__Na2Cr2O7+__HCl→__NaCl+__CrCl3+__Cl2↑+____,氧化剂_______,氧化产物__________。
反应⑥为:__ClO3-+__CrO2-+____→__Cl-+__CrO42-+__H2O,还原剂________,还原产物__________。
(2)在上述有编号的步骤中,除了①⑥外,需用氧化剂的步骤是(填编号)______。
【答案】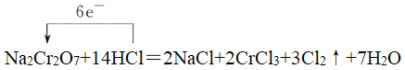 Na2Cr2O7 Cl2
Na2Cr2O7 Cl2 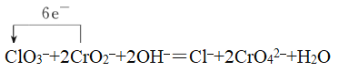 CrO2- Cl- ④
CrO2- Cl- ④
【解析】
(1)根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等,表现为化合价升降的总数相等进行解答;依据氧化还原反应的有关概念判断;
(2)需用还原剂的反应,应被还原,所含元素的化合价降低,需要氧化剂,物质被氧化,所含元素的化合价升高,从化合价的角度判断。
(1)在反应①Cr元素化合价由+6价降低到+3价,Cl元素化合价由-1价升高到0价,则根据化合价升降总数相等结合质量守恒可知配平后的方程式应为Na2Cr2O7+14HCl=2NaCl+2CrCl3+3Cl2↑+7H2O,反应中氧化剂为Na2Cr2O7,氧化产物为Cl2,用单线桥表示电子转移的方向、数目,可表示为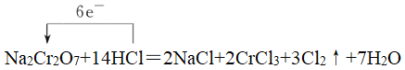 ;
;
在反应⑥中Cl元素化合价从+5价降低到-1价,Cr元素化合价从+3价升高到+6价,则根据化合价升降总数相等结合质量守恒可知配平后的方程式应为ClO3-+2CrO2-+2OH-=Cl-+2CrO42-+H2O,其中还原剂是CrO2-,还原产物为Cl-,用单线桥表示电子转移的方向、数目,可表示为 ;
;
(2)根据转化关系图可知②③中Cr元素化合价不变,④中Cr元素化合价升高,需加入氧化剂,⑤中Cr元素化合价不变,答案选④。

【题目】(1)将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_________(填“酸性”“碱性”或“中性”),溶液中[Na+]______[CH3COO-](填“>” “<”或“=”)。
(2)常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈__________(填“酸性”“碱性”或“中性”),溶液中[Na+]______[CH3COO-](填“>” “<”或“=”)。
(3)物质的量浓度相等的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈_______________(填“酸性”“碱性”或“中性”),醋酸溶液的体积______(填“>” “<”或“=”)氢氧化钠溶液的体积。
(4)将mmol·L-1的醋酸和nmol·L-1的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)_______氢氧化钠溶液中c(OH-)(填“>” “<”或“=”),m与n的大小关系式_____________________。
【答案】 碱性 > 酸性 < 中性 > < m>n
【解析】本题主要考查弱酸电离及其盐类水解。
(1)将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,形成醋酸钠溶液,醋酸钠水解使溶液呈碱性,溶液中电荷守恒:[H+]+[Na+]=[CH3COO-]+[OH-],且碱性溶液中,[H+]<[OH-],所以[Na+]>[CH3COO-]。
(2)醋酸难电离,常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,由于醋酸浓度较大而剩余,醋酸电离使溶液呈酸性,溶液中电荷守恒:[H+]+[Na+]=[CH3COO-]+[OH-],且酸性溶液中,[H+]>[OH-],所以[Na+]<[CH3COO-]。
(3)物质的量浓度相等的醋酸和氢氧化钠溶液混合后,溶液中电荷守恒:[H+]+[Na+]=[CH3COO-]+[OH-],由于溶液中醋酸根离子和钠离子浓度相等,所以[H+]=[OH-],则混合后溶液呈中性,与(1)比较可知醋酸溶液的体积>氢氧化钠溶液的体积。
(4)将mmol·L-1的醋酸和nmol·L-1的氢氧化钠溶液等体积混合后溶液的pH=7,由于醋酸难电离,则醋酸溶液中c(H+)<氢氧化钠溶液中c(OH-),与(1)比较可知m与n的大小关系式为m>n。
【题型】填空题
【结束】
23
【题目】某温度(T℃)下的溶液中,[H+]=10-xmol·L-1,[OH-]=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:
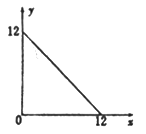
(1)此温度下,水的离子积KW=______________,则该温度T________25℃(填“>” “<”或“=”)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH 如下表所示:
实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则a=________, 实验②中由水电离产生的[OH-]=______mol·L-1。
(3)在此温度下,将0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1 mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.1 mol L-l NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显__________性(填“酸”“碱”或“中”)。
②写出按乙方式混合后,反应的离子方程式:____________________ 。
③按甲方式混合后,所得溶液的pH 为_____________。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a________(填“>” “<”或“=”)0.01;用含a的代数式表示HCN 的电离常数Ka=___________。