题目内容
3.下列可用氢键来解释的是( )| A. | 浓的氢氟酸溶液中存在HF${\;}_{2}^{-}$和H2F${\;}_{3}^{-}$ | |
| B. | SiH4沸点比CH4高 | |
| C. | 水和乙醇分别与金属钠反应,前者比后者剧烈 | |
| D. | H2O比H2S稳定,前者1000℃以上才分解,后者300℃分解 |
分析 原子半径小、吸引电子能力强的F、O、N与H原子间易形成氢键,氢键的存在可能会形成缔合物,影响物质的物理性质,由此分析解答.
解答 解:A、因氢键的存在形成缔合物,所以浓的氢氟酸溶液中存在HF${\;}_{2}^{-}$和H2F${\;}_{3}^{-}$,与氢键有关,故A正确;
B、分子间不存在氢键,是因SiH4的相对分子质量比CH4的相对分子质量大,从而造成前者分子间作用力大,与氢键无关,故B错误;
C、是化学性质,与羟基的活泼性有关,与氢键无关,故C错误;
D、稳定性是化学性质,与氢键无关,氢键是决定物理性质,与氢键无关,故D错误;
故选A.
点评 本题考查化学键的相关知识,学生要掌握①氢键是一种分子间的相互作用,不属于化学键;②能形成氢键的物质主要有NH3、H2O、HF;③特征:比化学键弱,比分子间作用力强影响物质的物理性质.

练习册系列答案
相关题目
18.下列离子方程式正确的是( )
| A. | 铝与NaOH溶液反应:Al+6OH-═[Al(OH)4]-+H2↑ | |
| B. | 向AlCl3溶液中滴入过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| C. | Al2O3与NaOH溶液反应:Al2O3+2OH-+3H2O═2[Al(OH)4]- | |
| D. | Ba(OH)2溶液与明矾溶液反应至Al3+完全沉淀:Ba2++3OH-+Al3++SO42-═Al(OH)3↓+BaSO4↓ |
19. 常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )
 常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )| A. | MOH为强碱 | |
| B. | 该混合液pH=7 | |
| C. | 该混合溶液中:c(Cl-)=c(M+) | |
| D. | 图中X表示M+,Y表示H+,Y表示MOH,R表示OH- |
11.用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 标准状况下,22.4L CCl4中含有共用电子对数目为4.0NA | |
| B. | 1 L 0.2 mol•L-1硫酸铁溶液中含有的SO42-数为0.2NA | |
| C. | 1 mol CO2与1 mol Na2O2完全反应时,转移的电子数目为NA | |
| D. | 9.2 g NO2气体中含有分子数目为0.2NA |
18.下列表示式错误的是( )
| A. | Na+的轨道表示式: | B. | Na+的结构示意图: | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化电子排布式:[Ne]3s1 |
15.1,5-戊二醛(简称GA)是一种重要的饱和直链二元醛.2%的GA溶液对禽流感、口蹄疫等疾病有良好的防治作用.根据上述信息,判断下列说法中正确的是( )
| A. | 戊二醛的分子式为C5H8O2,符合此分子式的二元醛有5种 | |
| B. | 戊二醛不能使酸性高锰酸钾溶液褪色 | |
| C. | 戊二醛经催化氧化可以得到的戊二酸有4种同分异构体 | |
| D. | 1mol的戊二醛与足量的银氨溶液反应,最多可得2mol单质银 |
13.下表列出了某短周期元素R的各级电离能数据(用I1、I2…表示,单位为kJ•mol-1).下列关于元素R的判断中一定正确的是( )
①R的最高正价为+3价
②R元素位于元素周期表中第ⅡA族
③R元素第一电离能大于同周期相邻元素
④R元素基态原子的电子排布式为1s22s2.
| I1 | I2 | I3 | I4 | … | |
| R | 740 | 1 500 | 7 700 | 10 500 |
②R元素位于元素周期表中第ⅡA族
③R元素第一电离能大于同周期相邻元素
④R元素基态原子的电子排布式为1s22s2.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
 的名称为2-甲基-2,4-己二烯.
的名称为2-甲基-2,4-己二烯. 该物质所含官能团的名称分别为羟基、酯基、羧基.
该物质所含官能团的名称分别为羟基、酯基、羧基. 进行一氯取代反应后,只能生成3种沸点不同产物.
进行一氯取代反应后,只能生成3种沸点不同产物.
 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$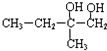 +2NaBr,反应类型是取代反应.
+2NaBr,反应类型是取代反应.