题目内容
在一定条件下,已达平衡的可逆反应:2A(g)+B(g)  2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )
A.平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=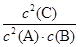 |
| B.改变条件后,该反应的平衡常数K一定不变 |
| C.如果改变压强并加入催化剂,平衡常数会随之变化 |
| D.若平衡时增加A和B的浓度,则平衡常数会减小 |
A
解析试题分析:对于在一定条件下进行的可逆反应来说,当反应达到化学平衡时,各生成物的浓度幂指数的乘积与各反应物的浓度幂指数乘积的比是个常数。这个常数就是化学平衡常数。化学平衡常数只与温度有关。而与浓度、压强等无关。根据化学平衡常数的定义可知A.平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=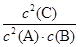 是正确的。B.如果改变的条件温度,则该反应的平衡常数K改变,若改变的是其它条件,则平衡常数K不变。错误。C.如果改变压强并加入催化剂,温度没变,平衡常数也不会随之变化。错误。D.若平衡时只是增加A和B的浓度,并未改变温度,平衡常数不变。错误。
是正确的。B.如果改变的条件温度,则该反应的平衡常数K改变,若改变的是其它条件,则平衡常数K不变。错误。C.如果改变压强并加入催化剂,温度没变,平衡常数也不会随之变化。错误。D.若平衡时只是增加A和B的浓度,并未改变温度,平衡常数不变。错误。
考点:考查外界因素与化学平衡常数的关系的知识。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案对于反应:H2(g)+I2(g) 2HI(g),在一恒定压强的容器中进行,下列可以判断此反应达到平衡状态的是( )
2HI(g),在一恒定压强的容器中进行,下列可以判断此反应达到平衡状态的是( )
| A.混合气体的体积保持不变 | B.混合气体的密度保持不变 |
| C.混合气体平均相对分子质量保持不变 | D.混合气体颜色保持不变 |
在密闭容器中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,C的浓度为原平衡的1.6倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,C的浓度为原平衡的1.6倍,下列叙述正确的是
| A.A的转化率变大 | B.平衡向正反应方向移动 |
| C.D的质量分数变大 | D.a<c+d |
对于A2+3B2 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是
A.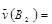 0.8mol·L-1·s-1 0.8mol·L-1·s-1 | B. 0.7mol·L-1·s-1 0.7mol·L-1·s-1 |
C. 0.4mol·L-1·s-1 0.4mol·L-1·s-1 | D.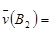 54mol·L-1·min-1 54mol·L-1·min-1 |
反应4NH3+5O2 4NO+6H2O(g),在5L的密闭容器中进行半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率υ(x)(表示反应物的消耗速率或生成物的生成速率)为 ( )
4NO+6H2O(g),在5L的密闭容器中进行半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率υ(x)(表示反应物的消耗速率或生成物的生成速率)为 ( )
| A.υ(O2)="0.001" mol·L-1·s-1 | B.υ(NO)="0.06" mol·L-1·s-1 |
| C.υ(H2O) ="0.003" mol·L-1·s-1 | D.υ(NH3)="0.001" mol·L-1·s-1 |
硫代硫酸钠与稀盐酸的反应Na2S2O3+2HCl→2NaCl+S↓+SO2↑+H2O在加热条件下反应速度加快,原因主要是
| A.该反应是吸热反应,且可逆,加热使平衡向正向移动 |
| B.加热促使SO2逸出,使平衡向正向移动 |
| C.加热促进S2O32-与H+的碰撞,使反应加速 |
| D.加热促进Na+与Cl-的碰撞,使反应加速 |
已知A(s)+2B(g)  2C(g)+D(g) △H<0 在一密闭容器中反应的υ-t图。t1时,改变了一个条件,下列叙述正确的是
2C(g)+D(g) △H<0 在一密闭容器中反应的υ-t图。t1时,改变了一个条件,下列叙述正确的是
| A.t1时,一定是升高了反应的温度 |
| B.t1时,可能是向容器中通入了一定量的C气体 |
| C.t1时,可能是向容器中加入了催化剂 |
| D.t1时改变外界条件后,该反应的平衡常数可能减小,也可能不变 |
化学反应C(s)+H2O(g) CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是
CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是
| A.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| B.加入固体碳,平衡向正反应方向移动 |
| C.加入水蒸气使容器压强增大,平衡向逆反应方向移动动 |
| D.减小压强,平衡向正反应方向移 |
对于可逆反应2HI(g)  I2(g)+H2(g),下列叙述能够说明已达到平衡状态的是
I2(g)+H2(g),下列叙述能够说明已达到平衡状态的是
| A.各物质的量的浓度比2 : 1: 1 |
| B.容器内的总压不随时间变化 |
| C.生成2 mol H-I键的同时生成1 mol I-I键 |
| D.混合气体的颜色不再变化时 |