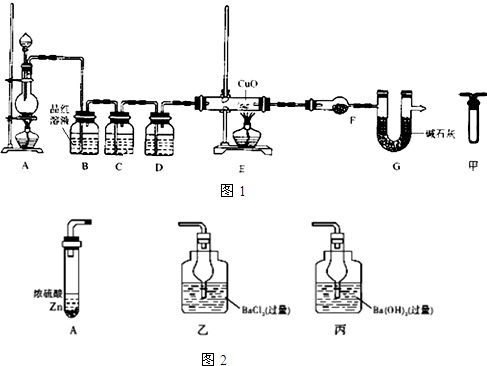
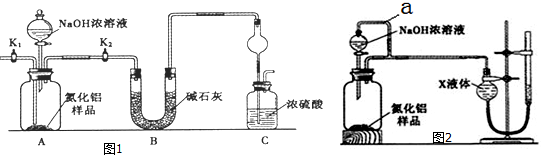
题目内容
15.下列说法正确的是( )| A. | 饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大 | |
| B. | 反应MgCl2(l)=Mg(l)+Cl2(g)的△H<0△S>0 | |
| C. | 等浓度的系列稀溶液:①硫酸氢钠②乙酸钠③醋酸④碳酸氢钠,它们的PH由小到大排列的为③①④② | |
| D. | 0.1mol•L-1 Na2SO3溶液中:c(OH-)-c(H+)═2 c(H2SO3)+c(HSO3-) |
分析 A.温度升高,抑制氢氧化钙的溶解,但是饱和溶液的浓度不变;
B.反应MgCl2(l)=Mg(l)+Cl2(g)的△H>0△S>0;
C.先按照物质的类别分为碱、盐、酸进行分类,在此基础上主要考虑盐的水解,判断盐溶液的酸碱性再进行比较;
D.从物料守恒和电荷守恒两个角度列式比较.
解答 解:A.加入生石灰后,生石灰与水反应生成氢氧化钙,溶剂的质量减少,析出氢氧化钙,剩余溶液仍为饱和溶液,浓度不变,PH不变,故A错误;
B.MgCl2的分解反应属于吸热反应,△H>0,反应后生成气体,熵变增加,△S>0,故B错误;
C.等浓度时,①硫酸氢钠相当于一元强酸,③醋酸为一元弱酸,④碳酸氢钠、②乙酸钠水解都呈碱性,且水解程度依次减小,所以溶液pH:④>②,所以溶液pH由小到大的顺序为,①③②④,故C错误;
D.0.1mol•L-1Na2SO3溶液中,根据物料守恒有:c(Na+)=2c(H2SO3)+2c(HSO3-)+2c(SO32-),根据溶液电中性有:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),则:c(OH-)-c(H+)=c(Na+)-c(HSO3-)-2c(SO32-)=2c(H2SO3)+2c(HSO3-)+2c(SO32-)-c(HSO3-)-2c(SO32-)=2c(H2SO3)+c(HSO3-),故D正确;
故选D.
点评 本题考查离子浓度的大小比较等问题,题目难度较大,本题易错点为D项,注意从溶液中存在的电荷守恒、质子守恒、物料守恒的角度分析.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
10.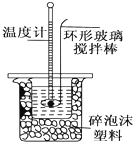 某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol•L-1 NaOH溶液.若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体0.50mol•L-1×0.25L×40g•mol-1=5.0 g.(请列式计算出结果,无列式,结果不给分)
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ•mol-1):_$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1_.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
②近似认为0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•(g•℃)-1.则中和热△H=-53.5kJ/mol(取小数点后一位).
③上述实验数据结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)a、b、c、d.
a.实验装置保温、隔热效果差
b.配制NaOH溶液定容时仰视刻度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol•L-1 NaOH溶液.若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体0.50mol•L-1×0.25L×40g•mol-1=5.0 g.(请列式计算出结果,无列式,结果不给分)
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ•mol-1):_$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1_.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)℃ | ||
| H2SO | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数据结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)a、b、c、d.
a.实验装置保温、隔热效果差
b.配制NaOH溶液定容时仰视刻度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
4.适量CO2通入含0.8gNaOH的碱溶液中,将所得的溶液在减压、低温下蒸干 后得到1.0g固体物质,则该固体物质的成分是( )
| A. | Na2CO3 | B. | NaHCO3 | C. | Na2CO3、NaHCO3 | D. | Na2CO3、NaOH |
5.能正确表示下列反应的离子方程式的是( )
| A. | 标况下将112mL氯气通入10mL 1mol•L-1的碘化亚铁溶液中:Cl2+2I-═2Cl-+I2 | |
| B. | 用FeS去除工厂废水中的Hg2+:Hg2++S2-═HgS↓ | |
| C. | NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ | |
| D. | 用醋酸除去水壶中的水垢:CaCO3+2H+═Ca2++H2O+CO2↑ |