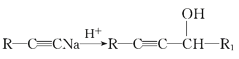
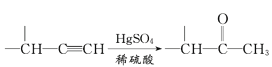
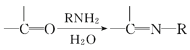
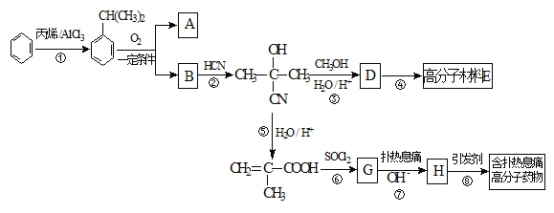
题目内容
【题目】铁、钴、镍及化合物在机械制造、磁性材料、新型电池或高效催化剂等许多领域都有着广泛的应用。请回答下列问题:
![]() 基态Ni原子的价电子排布式为_______。镍与CO生成的配合物
基态Ni原子的价电子排布式为_______。镍与CO生成的配合物![]() ,
,![]() 中含有的
中含有的![]() 键数目为_________;写出与CO互为等电子体的阴离子的化学式_________。
键数目为_________;写出与CO互为等电子体的阴离子的化学式_________。
![]() 研究发现,在
研究发现,在![]() 低压合成甲醇反应
低压合成甲醇反应![]() 中,Co氧化物负载的纳米粒子催化剂具有高活性,显示出良好的应用前景。
中,Co氧化物负载的纳米粒子催化剂具有高活性,显示出良好的应用前景。
![]() 元素Co与O中,第一电离能较大的是_______。
元素Co与O中,第一电离能较大的是_______。
![]() 生成物
生成物![]() 与
与![]() 中,沸点较高的是________,原因是___________。
中,沸点较高的是________,原因是___________。
![]() 用KCN处理含
用KCN处理含![]() 的盐溶液,有红色的
的盐溶液,有红色的![]() 析出,将它溶于过量的KCN溶液后,可生成紫色的
析出,将它溶于过量的KCN溶液后,可生成紫色的![]() 。
。![]() 具有强还原性,在加热时能与水反应生成淡黄色的
具有强还原性,在加热时能与水反应生成淡黄色的![]() ,写出该反应的离子方程式____________。
,写出该反应的离子方程式____________。
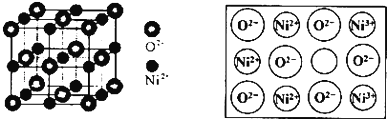
![]() 铁有
铁有![]() 、
、![]() 、
、![]() 三种同素异形体
三种同素异形体![]() 如图
如图![]() ,
,![]() 、
、![]() 两种晶胞中铁原子的配位数之比为_____。
两种晶胞中铁原子的配位数之比为_____。

![]() 若Fe原子半径为rpm,
若Fe原子半径为rpm,![]() 表示阿伏加德罗常数的值,则
表示阿伏加德罗常数的值,则![]() 单质的密度为_______
单质的密度为_______![]() 列出算式即可
列出算式即可![]() 。
。
![]() 在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为
在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为![]() 1,
1,![]() 晶面。如图,则
晶面。如图,则![]() 晶胞体中
晶胞体中![]() 1,
1,![]() 晶面共有_____个。
晶面共有_____个。

【答案】![]()
![]()
![]() 或
或![]()
![]()
![]()
![]() 的沸点较高,因为平均一个水分子能形成两个氢键
的沸点较高,因为平均一个水分子能形成两个氢键![]() 而平均一个
而平均一个![]() 分子只能形成一个氢键,氯键越多,熔沸点越高。所以
分子只能形成一个氢键,氯键越多,熔沸点越高。所以![]() 沸点高
沸点高 ![]()
![]() :3
:3 ![]() 4
4
【解析】
(1)Co为27号元素,位于第四周期第ⅤⅢ族;1个Ni(CO)4中含有4个配位键、4个共价三键,每个共价三键中含有一个σ键,配位键也属于σ键;与CO互为等电子体的阴离子中含有2个原子、价电子数是10;
(2)①O元素是非金属,Co是金属元素;
②氢键越多,熔沸点越高;
③[Co(CN)6]4-配离子具有强还原性,在加热时能与水反应生成淡黄色[Co(CN)6]3-,只能是水中氢元素被还原为氢气,根据电荷守恒有氢氧根离子生成;
(3)①δ晶胞为体心立方堆积,Fe原子配位数为8.a晶胞为简单立方堆积,Fe原子配位数为6;
②γ-Fe中顶点粒子占![]() ,面心粒子占
,面心粒子占![]() ,根据晶体密度ρ=
,根据晶体密度ρ=![]() 计算;
计算;
③在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面,该立方晶胞体中(1,1,1)晶面共有4个。
![]() 基态Ni原子的价电子为3d能级上的8个电子、4s能级上的2个电子,其价电子排布式为
基态Ni原子的价电子为3d能级上的8个电子、4s能级上的2个电子,其价电子排布式为![]() ;1个
;1个![]() 中含有4个配位键、4个共价三键,每个共价三键中含有一个
中含有4个配位键、4个共价三键,每个共价三键中含有一个![]() 键,配位键也属于
键,配位键也属于![]() 键,所以该分子中含有8个
键,所以该分子中含有8个![]() 键,则1mol该配合物中含有
键,则1mol该配合物中含有![]() 个
个![]() 键;与CO互为等电子体的阴离子中含有2个原子、价电子数是10,符合条件的阴离子为
键;与CO互为等电子体的阴离子中含有2个原子、价电子数是10,符合条件的阴离子为![]() 或
或![]() ;
;
![]() 元素Co与O中,由于O元素是非金属而Co是金属元素,O比Co原子更难失去电子,所以第一电离能较大的是O;
元素Co与O中,由于O元素是非金属而Co是金属元素,O比Co原子更难失去电子,所以第一电离能较大的是O;
![]() 与
与![]() 均为极性分子,
均为极性分子,![]() 中氢键比甲醇多。沸点从高到低的顺序为
中氢键比甲醇多。沸点从高到低的顺序为![]() ;具体地说,
;具体地说,![]() 的沸点较高,是因为平均一个水分子能形成两个氢键
的沸点较高,是因为平均一个水分子能形成两个氢键![]() 而平均一个
而平均一个![]() 分子只能形成一个氢键,氯键越多,熔沸点越高;所以
分子只能形成一个氢键,氯键越多,熔沸点越高;所以![]() 沸点高;
沸点高;
![]() 配离子具有强还原性,在加热时能与水反应生成淡黄色
配离子具有强还原性,在加热时能与水反应生成淡黄色![]() ,只能是水中氢元素被还原为氢气,根据电荷守恒有氢氧根离子生成,该反应离子方程式为:
,只能是水中氢元素被还原为氢气,根据电荷守恒有氢氧根离子生成,该反应离子方程式为:![]()
![]() ;
;
![]() 晶胞为体心立方堆积,Fe原子配位数为8;a晶胞为简单立方堆积,Fe原子配位数为6,则
晶胞为体心立方堆积,Fe原子配位数为8;a晶胞为简单立方堆积,Fe原子配位数为6,则![]() 、a两种晶胞中铁原子的配位数之比为8:
、a两种晶胞中铁原子的配位数之比为8:![]() :3;
:3;
![]() 中顶点粒子占
中顶点粒子占![]() ,面心粒子占
,面心粒子占![]() ,则一个晶胞中含有Fe的个数为
,则一个晶胞中含有Fe的个数为![]() 个,不妨取1mol这样的晶胞,即有
个,不妨取1mol这样的晶胞,即有![]() 个这样的晶胞,1mol晶胞的质量为
个这样的晶胞,1mol晶胞的质量为![]() ,根据立体几何知识,晶胞边长a与Fe的半径的关系为
,根据立体几何知识,晶胞边长a与Fe的半径的关系为![]() ,所以
,所以![]() ,则一个晶胞体积为
,则一个晶胞体积为![]() ,所以晶体密度为:
,所以晶体密度为:![]() ;
;
![]() 观察图可得在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为
观察图可得在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为![]() 1,
1,![]() 晶面,该立方晶胞体中
晶面,该立方晶胞体中![]() 1,
1,![]() 晶面共有4个。
晶面共有4个。