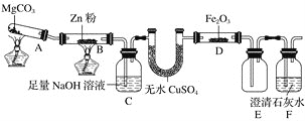
题目内容
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含原子个数比为__,分子的物质的量之比为__。
(2)等温、等压下,等体积的O2和O3所含分子个数比为__,质量比为___。
(3)设NA为阿伏加德罗常数的数值,如果ag氧气中含有的分子数为b,则cg氧气在标准状况下的体积约是___(用含NA的式子表示)。
(4)常温下,将20g质量分数为14%的KNO3溶液跟30g质量分数为24%的KNO3溶液混合,得到密度为1.15g·cm-3的混合溶液。该混合溶液的物质的量浓度为___mol·L-1。
【答案】1:1 3:2 1:1 2:3 ![]() L 2.28
L 2.28
【解析】
(1)等质量的O2和O3的物质的量之比为![]() ∶
∶![]() =3∶2,则所含分子个数之比为3∶2,原子个数之比为1∶1,故答案为:1:1;3:2;
=3∶2,则所含分子个数之比为3∶2,原子个数之比为1∶1,故答案为:1:1;3:2;
(2)据阿伏加德罗定律可知,同温同压下,等体积的气体含有相同数目的分子,即O2和O3所含分子数之比为1∶1,则原子个数比为2∶3,质量比为2∶3,故答案为:1:1;2:3;
(3)氧气的摩尔质量为M=![]() =
=![]() =
=![]() g·mol-1,则cg O2在标准状况下体积为V=
g·mol-1,则cg O2在标准状况下体积为V=![]() ·Vm=
·Vm=![]() ×22.4 L·mol-1=
×22.4 L·mol-1=![]() L,故答案为:
L,故答案为:![]() L;
L;
(4)混合后溶液中的KNO3的物质的量为n(KNO3)=![]() ≈0.099 mol,混合后溶液的总体积为V[KNO3(aq)]=
≈0.099 mol,混合后溶液的总体积为V[KNO3(aq)]=![]() ≈43.5 cm3=4.35×10-2L,混合后溶液中KNO3的物质的量浓度为c(KNO3)=
≈43.5 cm3=4.35×10-2L,混合后溶液中KNO3的物质的量浓度为c(KNO3)=![]() ≈2.28mol·L-1,故答案为:2.28。
≈2.28mol·L-1,故答案为:2.28。

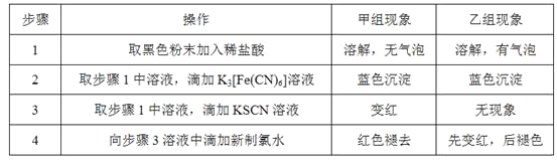
【题目】已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应:H2O2+2H++2I-→2H2O+I2,且生成的I2立即与试剂X反应而被消耗。一段时间后,试剂X将被反应生成的I2完全消耗。由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-→2H2O+I2的反应速率。
如表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
0.1mol·Lˉ1KI溶液 | H2O | 0.01mol·Lˉ1X溶液 | 0.1mol·Lˉ1双氧水 | 1mol·Lˉ1稀盐酸 | |||
1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响。实验2中m=___,n=___。
(2)已知,I2与X反应时,两者物质的量之比为1∶2。按面表格中的X和KI的加入量,加入V(H2O2)>___,才确保看到蓝色。
(3)实验1,浓度c(X)~ t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X)~t的变化曲线图(进行相应的标注)。____
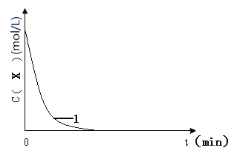
(4)实验3表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂___(填“提高”或“降低”)了反应活化能。
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
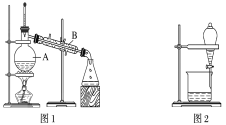
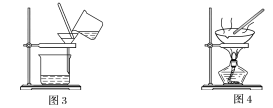
(1)装置图1中B的名称是________________,图2中漏斗的名称是________________。A中一般要加入碎瓷片,其作用是__________________________。下列关于以上实验操作说法一定正确的是_。
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度
D.图4实验中,当加热至有较多固体析出时,即停止加热
(2)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离可选用上图中的图________________所示仪器。
(3)在图2所示实验中,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。____。