题目内容
【题目】实验室需要400mL 0.5molL﹣1的稀硫酸溶液,现用密度为1.84gmL﹣1 , 质量分数为98%浓硫酸来配制,请回答下列问题:
(1)若要实施配制,下列仪器中,不会用到的是(填字母).
A.250mL容量瓶;
B.500mL容量瓶;
C.托盘天平;
D.量筒;
E.烧杯;
F.玻璃棒
(2)配制过程中,除上述仪器外,尚缺的仪器是 .
(3)未冷却至室温立即转移硫酸溶液,则所配硫酸溶液的浓度(填“偏高”、“偏低”或“无影响”,下同);若定容时,滴加蒸馏水不慎超过了刻度线,则所配硫酸溶液的浓度 .
(4)通过计算,用量筒量取mL浓硫酸.
【答案】
(1)AC
(2)胶头滴管
(3)偏高;偏低
(4)13.6
【解析】解:(1)用浓溶液配制一定物质的量浓度溶液步骤:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,需要的仪器:烧杯、量筒、玻璃棒、500mL容量瓶、胶头滴管;用不到的仪器:A.250mL容量瓶C.托盘天平;
所以答案是:AC;(2)依据(1)可知还缺少的仪器:胶头滴管;
所以答案是:胶头滴管;(3)未冷却至室温立即转移硫酸溶液,冷却后溶液体积偏小,溶液的物质的量浓度偏高;
若定容时,滴加蒸馏水不慎超过了刻度线,导致溶液体积偏大,溶液的物质的量浓度偏低;
所以答案是:偏高;偏低;(4)98%的浓硫酸(密度为1.84gml ﹣3)的物质的量浓度C= ![]() =18.4mol/L,设需要浓硫酸体积V,稀释前后溶质的物质的量不变,18.4mol/L×V=0.5molL﹣1×500mL,解得V=13.6mL;
=18.4mol/L,设需要浓硫酸体积V,稀释前后溶质的物质的量不变,18.4mol/L×V=0.5molL﹣1×500mL,解得V=13.6mL;
所以答案是:13.6.

【题目】某化学兴趣小组为探究浓硫酸的性质,设计了如下图所示的装置进行实验. 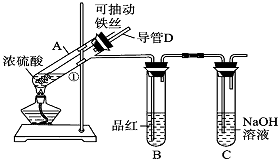
(1)用“可抽动的铁丝”代替“直接投入铁片”的优点是 .
(2)说明SO2气体产生的实验现象是;装置C的作用是 .
(3)反应一段时间后,他们对试管A中溶液的金属离子进行探究,请完成相关试题:
①提出假设:假设1:只含有Fe3+;
假设2:只含有Fe2+;
假设3:既有Fe2+ , 又有Fe3+ .
②请设计实验方案验证假设3.
限选试剂:稀硫酸、KMnO4溶液、KSCN溶液、NaOH溶液、H2O2溶液.
实验步骤 | 预期现象 |
步骤一:用胶头滴管取出A试管中的溶液,用水稀释后,并分装在试管Ⅰ、Ⅱ中备用 | |
步骤二:检验Fe3+ , 往试管Ⅰ中, | |
步骤三:检验Fe2+ , 往试管Ⅱ中, |
(4)已知C+2H2SO4(浓) ![]() 2SO2↑+CO2↑+2H2O,该反应体现浓硫酸的性.
2SO2↑+CO2↑+2H2O,该反应体现浓硫酸的性.
A.脱水性 B.强氧化性 C.吸水性
若要验证反应产物中同时混有SO2气体和CO2气体,可选择以下试剂进行实验:
①NaOH溶液②品红溶液③溴水④Ca(OH)2溶液,选择合适试剂并安排合理的顺序为 .