题目内容
【题目】水是生命之源,它与我们的生活密切相关。
(1)自来水厂常用高铁酸钾(K2FeO4)改善水质。简述高铁酸钾用于杀菌消毒同时又起到净水作用的原理_____________________________________________________________。
(2)电镀废水中含有剧毒的NaCN,加入NaClO处理该碱性废水时生成Na2CO3、NaCl和N2。
①写出该反应的离子方程式:__________________________________________。
②处理a m3含NaCN bmg·L-1的废水,至少需要NaC1O的质量为______________g。
(3)某工业废水中可能含有Na+、Mg2+、A13+、Fe3+、NH4+、CO32-、SO42-、NO3-中的几种,为确定其成分,设计如下实验:
a.取该废水进行焰色反应实验,火焰为黄色;
b.另取10mL该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,充分反应后过滤得到4.66g白色沉淀;
c.另取10mL该废水于试管中,滴加NaOH溶液,产生沉淀的质量随所加NaOH溶液体积的变化关系如下图所示(不考虑沉淀的溶解和损失)。
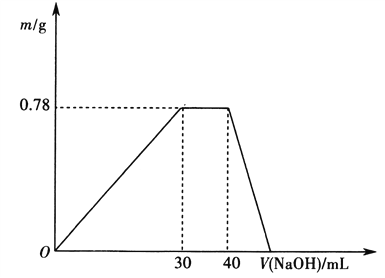
根据上述实验和图表数据回答:
①该工业废水中一定不存在的离子有_________________(写离子符号)。
②c(NaOH)=_____________________。
③NO3-是否存在?_______(填“存在”、“不存在”或“不确定”),理由是_____________________________________________________
【答案】 K2FeO4具有强氧化性,能杀菌消毒,生成的Fe3+水解生成氢氧化铁胶体,能凝聚水中的悬浮物,达到净水的目的 5ClO-+2CN-+2OH-=5Cl-+2CO32-+N2↑+H2O 3.8ab Mg2+、Fe3+、CO32- 1.0mol·L-1 存在 由题意得,溶液中n(SO42-)=0.02mol,n(Al3+)=0.01mol,n(NH4+)=0.01mol,且含有Na+,根据电荷守恒可知,溶液中一定含有NO3-
【解析】(1)高铁酸钾中铁元素的价态是+6价,K2FeO4具有强氧化性,能杀菌消毒,同时生成的Fe3+水解生成氢氧化铁胶体,能凝聚水中的悬浮物,达到净水的目的。(2)①反应中C、N元素化合价分别从+2价、-3价升高到+4价和0价,氯元素化合价从+1价降低到-1价,因此根据电子得失守恒和原子守恒可知该反应的离子方程式为5ClO-+2CN-+2OH-=5Cl-+2CO32-+N2↑+H2O。②根据方程式可知处理am3含NaCNbmg·L-1的废水,至少需要NaClO的质量为![]() 。(3)a.取该废水进行焰色反应实验,火焰为黄色,一定含有Na+;b.另取10mL该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,充分反应后过滤得到4.66g白色沉淀,沉淀一定是硫酸钡,因此一定存在SO42-,物质的量是4.66g÷233g/mol=0.02mol;c.根据图像可知开始即产生沉淀,达到最大值后沉淀不变化,这说明还含有铵根。最后沉淀完全消失,所以沉淀一定是氢氧化铝,即一定存在铝离子,不存在镁离子、铁离子和碳酸根离子。氢氧化铝是0.78g,物质的量是0.01mol,消耗氢氧化钠是0.03mol,沉淀铝离子消耗氢氧化钠溶液是30mL,则氢氧化钠的物质的量浓度是0.03mol÷0.03L=1.0mol/L;与铵根反应消耗氢氧化钠溶液是10mL,物质的量是0.01mol,则铵根是0.01mol。①根据以上分析可知该工业废水中一定不存在的离子有Mg2+、Fe3+、CO32-。②c(NaOH)=1.0mol·L-1。③由题意得,溶液中n(SO42-)=0.02mol,n(Al3+)=0.01mol,n(NH4+)=0.01mol,且含有Na+,根据电荷守恒可知,溶液中一定含有NO3-。
。(3)a.取该废水进行焰色反应实验,火焰为黄色,一定含有Na+;b.另取10mL该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,充分反应后过滤得到4.66g白色沉淀,沉淀一定是硫酸钡,因此一定存在SO42-,物质的量是4.66g÷233g/mol=0.02mol;c.根据图像可知开始即产生沉淀,达到最大值后沉淀不变化,这说明还含有铵根。最后沉淀完全消失,所以沉淀一定是氢氧化铝,即一定存在铝离子,不存在镁离子、铁离子和碳酸根离子。氢氧化铝是0.78g,物质的量是0.01mol,消耗氢氧化钠是0.03mol,沉淀铝离子消耗氢氧化钠溶液是30mL,则氢氧化钠的物质的量浓度是0.03mol÷0.03L=1.0mol/L;与铵根反应消耗氢氧化钠溶液是10mL,物质的量是0.01mol,则铵根是0.01mol。①根据以上分析可知该工业废水中一定不存在的离子有Mg2+、Fe3+、CO32-。②c(NaOH)=1.0mol·L-1。③由题意得,溶液中n(SO42-)=0.02mol,n(Al3+)=0.01mol,n(NH4+)=0.01mol,且含有Na+,根据电荷守恒可知,溶液中一定含有NO3-。

 阅读快车系列答案
阅读快车系列答案【题目】表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
化学式 | CH3COOH | HClO | H2CO3 |
Ka | 1.8×10﹣5 | 3.0×10﹣8 | Ka1=4.1×10﹣7 Ka2=5.6×10﹣11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B. 向0.1mol·L﹣1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时溶液中c(CH3COOH):c(CH3COO﹣)=9:5
C. 少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D. 等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后