题目内容
【题目】氨气是一种重要的工业原料,可以制备如下图所示的一系列物质(部分产物未标出)
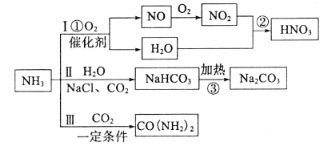
(1)线路Ⅰ为硝酸的制备
写出反应①的化学方程式________;反应②中氧化剂与还原剂的物质的量之比为_______,工业尾气中的氮氧化物常采用碱液法吸收,若NO与NO2按物质的量之比1:1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是_______。
(2)路线为Ⅱ纯碱的制备
写出反应③的化学方程式________,最终得到的纯碱中可能含有NaCl,检验是否存在NaCl的实验方案是________
(3)路线Ⅲ为尿素的制备
写出合成尿素的化学方程式________
(4)实验室中需要少量氨气,写出制备氨气的化学方程式________
【答案】4NH3+5O2![]() 4NO+6H2O 1:2 NaNO2 2NaHCO3
4NO+6H2O 1:2 NaNO2 2NaHCO3 ![]() Na2CO3十H2O+CO2↑ 取少量样品于试管中并加水溶解,加入足量稀硝酸,再加入硝酸银溶液,若岀现白色沉淀,则证明纯碱中含有NaCl 2NH3+CO2
Na2CO3十H2O+CO2↑ 取少量样品于试管中并加水溶解,加入足量稀硝酸,再加入硝酸银溶液,若岀现白色沉淀,则证明纯碱中含有NaCl 2NH3+CO2![]() CO(NH2)2+H2O 2NH4Cl+Ca(OH)2
CO(NH2)2+H2O 2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
【解析】
根据图中物质书写方程式,掌握氧化还原反应的中氧化剂和还原剂的分析,根据碳酸氢钠的受热分解书写方程式,根据实验室用氯化铵和氢氧化钙制取氨气写方程式。
(1)氨气和氧气反应生成一氧化氮和水,方程式为4NH3+5O2![]() 4NO+6H2O ;反应②为二氧化氮和水反应生成硝酸和一氧化氮,其中二氧化氮做氧化剂和还原剂,比例为 1:2;NO与NO2按物质的量之比1:1被足量NaOH溶液完全吸收后只得到一种钠盐,根据元素化合价变化分析,生成物中氮元素的化合价只能为+3价,则该钠盐的化学式是NaNO2;
4NO+6H2O ;反应②为二氧化氮和水反应生成硝酸和一氧化氮,其中二氧化氮做氧化剂和还原剂,比例为 1:2;NO与NO2按物质的量之比1:1被足量NaOH溶液完全吸收后只得到一种钠盐,根据元素化合价变化分析,生成物中氮元素的化合价只能为+3价,则该钠盐的化学式是NaNO2;
(2)碳酸氢钠受热分解生成碳酸钠和水和二氧化碳,方程式为2NaHCO3 ![]() Na2CO3 +H2O+CO2↑,检验碳酸钠中是否含有氯化钠,应先排除碳酸根离子的干扰,即加入足量的硝酸将溶液酸化,再检验氯离子,方法为取少量样品于试管中并加水溶解,加入足量稀硝酸将溶液酸化,再加入少量的硝酸银溶液,若岀现白色沉淀,则证明纯碱中含有NaCl;
Na2CO3 +H2O+CO2↑,检验碳酸钠中是否含有氯化钠,应先排除碳酸根离子的干扰,即加入足量的硝酸将溶液酸化,再检验氯离子,方法为取少量样品于试管中并加水溶解,加入足量稀硝酸将溶液酸化,再加入少量的硝酸银溶液,若岀现白色沉淀,则证明纯碱中含有NaCl;
(3)氨气和二氧化碳反应生成尿素和水,方程式为:2NH3+CO2![]() CO(NH2)2+H2O;
CO(NH2)2+H2O;
(4)实验室用氯化铵和氢氧化钙反应生成氨气,方程式为: 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】无水氯化铝是一种重要的化工原料,某研究性学习小组查阅资料后利用图1所示装置制备无水氯化铝(反应温度为450℃-500℃)。资料显示:氯化铝为无色透明晶体或白色而微带浅黄色的结晶性粉末,在178℃ 升华,在空气中能吸收水分,发生水解。
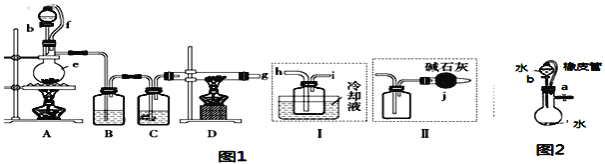
回答下列问题:
(1)某同学检验装置A部分的气密性,如图2所示,关闭图装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断:A部分装置是否漏气?____________ (填“漏气”、“不漏气”或“无法确定”),判断理由:________________________。
(2)装置e的名称是_______________________。
(3)某学习小组设计了以下两种实验方案:方案甲:g接装置I;方案乙:g接装置II。但是甲乙两个方案中虚线内装置均有不足之处,请你评价后填写下表。
方案 | 不足之处 |
甲 | ______ |
乙 | ______ |
(4)在上述(3)的评价基础上,请设计一个合理方案:______________________。
(5)A部分装置中发生反应生成氯气的离子方程式为___________________________,若生成标准状况下的氯气22.4L,需要10mol·L-1的浓盐酸的体积______400mL(填大于、小于或等于)。

