题目内容
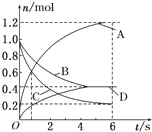
【题目】一定条件下在2L的密闭容器中充入2molSO2和2molO2,发生反应: 2SO2(g)+O2(g) ![]() 2SO3(g),进行到4min时,测得n(SO2)=1.2mol。下列说法正确的是( )
2SO3(g),进行到4min时,测得n(SO2)=1.2mol。下列说法正确的是( )
A.反应进行到2min时,容器中n(SO3)可能为0.5mol
B.当v(SO2):v(O2):v(S03)=2:1:2 时该反应达平衡状态
C.温度升高时正反应速率增大,逆反应速率减小
D.4min内氧气的平均反应速率为0.5mol/(L·min)
【答案】A
【解析】
试题分析:A.进行到4min时,测得n(SO2)=1.2mol,这说明消耗二氧化硫是0.8mol,生成SO2是0.8mol,由于反应速率逐渐减小,则反应进行到2min时,容器中n(SO3)可能为0.5mol,A正确;B.当v(SO2):v(O2):v(S03)=2:1:2 时正逆反应速率不一定相等,因此该反应达不一定达到平衡状态,B错误;C.温度升高时正反应速率增大,逆反应速率也增大,C错误;D.4min内消耗0.4mol,浓度是0.2mol/L,所以氧气的平均反应速率为0.2mol/L÷4min=0.05mol/(L·min),D错误,答案选A。

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( )
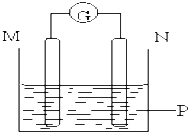
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A B.B C.C D.D