题目内容
6.下列变化过程中,同时有离子键、极性键、非极性键的断裂和形成的是( )| A. | 2NH4HCO3=2NH3+CO2+2H2O | B. | 2NaOH+Cl2=NaCl+NaClO+H2O | ||
| C. | 2Na2O2+2CO2=2Na2CO3+O2 | D. | H2+Cl2=2HCl |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性共价键,据此分析解答.
解答 解:A.该反应中有离子键和极性共价键的断裂和形成,没有非极性共价键的断裂和形成,故A错误;
B.该反应中没有极性共价键的断裂,故B错误;
C.过氧化钠中的离子键、非极性断裂、二氧化碳中的极性键断裂,且氧气中非极性键形成、碳酸钠中离子键、极性共价键形成,故C正确;
D.没有离子键的断裂和形成,故D错误.
故选C.
点评 本题考查化学反应及化学键,为高频考点,把握化学键判断的一般规律分析化学键的断裂和形成为解答的关键,注重分析能力和基础知识的考查,题目难度不大.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
16.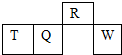 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | R的气态氢化物沸点低于同主族其它元素的氢化物 |
17.下列说法中正确的是( )
| A. | 32 gO3所含有的原子物质的量与1 mol O2所含原子物质的量相等 | |
| B. | 4 g金属钙变成钙离子时失去的电子数目为0.1 NA | |
| C. | 1 mol CH3+所含的电子数为10 NA | |
| D. | 标准状况下,22.4 L H2O所含的分子数为NA |
1.A、B两种烃,含碳的质量分数相同,下列关于A和B的叙述中,正确的是( )
| A. | 烃A和B的实验式相同 | |
| B. | 烃A和B一定是同分异构体 | |
| C. | 烃A和B不可能是同系物 | |
| D. | 烃A和B各取1 mol,完全燃烧时生成CO2的质量一定相等 |
18. 设H+的质荷比为β,其有机物样品的质荷比如图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )
设H+的质荷比为β,其有机物样品的质荷比如图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )
 设H+的质荷比为β,其有机物样品的质荷比如图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )
设H+的质荷比为β,其有机物样品的质荷比如图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )| A. | 甲醇(CH3OH) | B. | 甲烷 | C. | 丙烷 | D. | 乙烯 |
15.据美国《科学》杂志报道:在40GPa高压下,用激光器加热到1800K,制得具有高熔点、高硬度的二氧化碳晶体.下列关于该晶体的说法正确的是( )
| A. | 该晶体属于分子晶体 | |
| B. | 该晶体易汽化,可用作制冷材料 | |
| C. | 一定条件下,该晶体可跟氢氧化钠反应 | |
| D. | 每摩尔该晶体中含5 mol C-O键 |
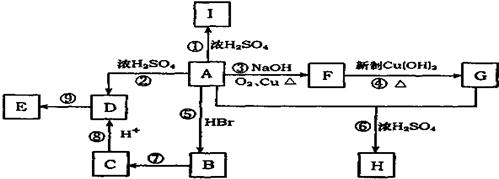 A
A ;
;  ;
;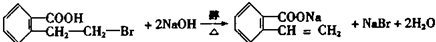 .
. .
.