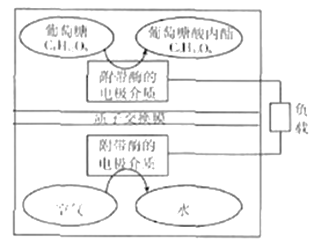
题目内容
【题目】甲胺(CH3NH2)是一种应用广泛的一元弱碱。常温下,向200mL0.10mol/L的甲胺溶液中滴加V mL.0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是
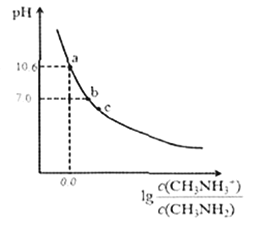
A. b点对应加入盐酸的体积V< 20.00mL
B. 甲胺在水中的电离方程式为:CH3NH2+H2O![]() CH3NH3++OH-
CH3NH3++OH-
C. 常温下,甲胺的电离常数为Kb,则pKb=-1gKb=4.3
D. c点可能存在关系: 2c(H+)+ c(CH3NH3+)=c(CH3NH2) +2c(OH- )+ c(Cl-)
【答案】C
【解析】甲胺的物质的量为:![]() 。A、当加入盐酸20.00mL时,HCl物质的量为:
。A、当加入盐酸20.00mL时,HCl物质的量为:![]() ,二者恰好完全反应生成CH3NH3+Cl- ,这是一种强酸弱碱盐,由于CH3NH3+水解溶液呈酸性,因此当盐酸适量减少时,溶液可以呈中性,所以b点pH=7的溶液,加入的HCl体积V<20.00 mL,A正确。B、甲胺的结构类似于氨气NH3,所以甲胺在水中的电离方程式为:CH3NH2+H2O
,二者恰好完全反应生成CH3NH3+Cl- ,这是一种强酸弱碱盐,由于CH3NH3+水解溶液呈酸性,因此当盐酸适量减少时,溶液可以呈中性,所以b点pH=7的溶液,加入的HCl体积V<20.00 mL,A正确。B、甲胺的结构类似于氨气NH3,所以甲胺在水中的电离方程式为:CH3NH2+H2O![]() CH3NH3++OH-,B正确。C、根据B甲胺的电离方程式,
CH3NH3++OH-,B正确。C、根据B甲胺的电离方程式,![]() ,读图可得,当
,读图可得,当![]() 时,pH=10.6,即
时,pH=10.6,即![]() 时,c(H+)=10-10.6,所以Kb= c(OH-)=10-(14-10.6)=10-3.4,pKb=-lgKb=-lg10-3.4=3.4,C错误。D、c点pH<7,溶液呈酸性,所以可能是A提到的消耗20mL盐酸时得到的CH3NH3Cl溶液,根据电荷守恒则有c(H+)+c(CH3NH3+)=c(OH-)+c(Cl-),既2c(H+)+2c(CH3NH3+)=2c(OH-)+c(Cl-)+c(Cl-),且溶液中的Cl原子数与N原子数相等,所以c(Cl-)=c(CH3NH3+)+c(CH3NH2),代入上述后一个等式得:2c(H+)+2c(CH3NH3+)=2c(OH-)+c(Cl-)+c(CH3NH3+)+c(CH3NH2),化简得到:2c(H+)+c(CH3NH3+)=c(CH3NH2)+2c(OH-)+c(Cl-),D正确。所以错误的答案选择C。
时,c(H+)=10-10.6,所以Kb= c(OH-)=10-(14-10.6)=10-3.4,pKb=-lgKb=-lg10-3.4=3.4,C错误。D、c点pH<7,溶液呈酸性,所以可能是A提到的消耗20mL盐酸时得到的CH3NH3Cl溶液,根据电荷守恒则有c(H+)+c(CH3NH3+)=c(OH-)+c(Cl-),既2c(H+)+2c(CH3NH3+)=2c(OH-)+c(Cl-)+c(Cl-),且溶液中的Cl原子数与N原子数相等,所以c(Cl-)=c(CH3NH3+)+c(CH3NH2),代入上述后一个等式得:2c(H+)+2c(CH3NH3+)=2c(OH-)+c(Cl-)+c(CH3NH3+)+c(CH3NH2),化简得到:2c(H+)+c(CH3NH3+)=c(CH3NH2)+2c(OH-)+c(Cl-),D正确。所以错误的答案选择C。