题目内容
【题目】硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:

回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应生成硼酸(H3BO3)的化学方程式_____________。为提高浸出速率,除适当增加硫酸的浓度外,还可采取的措施有_________(写出两条)。
(2)利用_______的磁性,可将其从“矿粉”中分离。“浸渣”中的物质是______(写化学式)。
(3) “净化除杂”需先加H2O2溶液,作用是(用离子方程式表示)_______。然后再调节溶液的pH约为5,目的是________。
(4)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为_______。
【答案】 Mg2B2O5·H2O+2H2SO4![]() 2MgSO4+2H3BO3 减小铁硼矿粉粒径、提高反应温度、搅拌或其它合理答案 Fe3O4 SiO2和CaSO4 2Fe2++H2O2+2H+=Fe3+ + 2H2O 使Al3+与Fe3+形成氢氧化物而除去
2MgSO4+2H3BO3 减小铁硼矿粉粒径、提高反应温度、搅拌或其它合理答案 Fe3O4 SiO2和CaSO4 2Fe2++H2O2+2H+=Fe3+ + 2H2O 使Al3+与Fe3+形成氢氧化物而除去 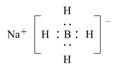
【解析】Fe3O4具有磁性,可将Fe3O4从“矿粉”中分离。“硫酸浸出”过程中,Mg2B2O5·H2O、Fe3O4、Fe2O3、FeO、CaO、Al2O3与硫酸反应生成MgSO4、H3BO3、Fe2(SO4)3、FeSO4、CaSO4、Al2(SO4)3,SiO2难溶于硫酸,过滤后的浸渣为SiO2和微溶于水的CaSO4;“净化除杂”加入H2O2将Fe2+氧化成Fe3+,然后调节pH约为5,根据流程,Fe3+、Al3+依次转化为Fe(OH)3、Al(OH)3沉淀而除去;滤液经蒸发浓缩、冷却结晶、过滤得到粗硼酸。
Fe3O4具有磁性,可将Fe3O4从“矿粉”中分离。“硫酸浸出”过程中,Mg2B2O5·H2O、Fe3O4、Fe2O3、FeO、CaO、Al2O3与硫酸反应生成MgSO4、H3BO3、Fe2(SO4)3、FeSO4、CaSO4、Al2(SO4)3,SiO2难溶于硫酸,过滤后的浸渣为SiO2和微溶于水的CaSO4;“净化除杂”加入H2O2将Fe2+氧化成Fe3+,然后调节pH约为5,根据流程,Fe3+、Al3+依次转化为Fe(OH)3、Al(OH)3沉淀而除去;滤液经蒸发浓缩、冷却结晶、过滤得到粗硼酸。
(1)Mg2B2O5·H2O与硫酸反应生成H3BO3、MgSO4,反应的化学方程式为Mg2B2O5·H2O+2H2SO4![]() 2MgSO4+2H3BO3。根据外界条件对化学反应速率的影响,为提高浸出速率,除适当增加硫酸的浓度外,还可采取的措施有:减小铁硼矿粉的粒径、提高反应温度、搅拌等。
2MgSO4+2H3BO3。根据外界条件对化学反应速率的影响,为提高浸出速率,除适当增加硫酸的浓度外,还可采取的措施有:减小铁硼矿粉的粒径、提高反应温度、搅拌等。
(2)利用Fe3O4的磁性,可将其从“矿粉”中分离。根据上述分析,SiO2难溶于硫酸,CaO与硫酸反应生成微溶于水的CaSO4,“浸渣”中的物质是SiO2和CaSO4。
(3)“硫酸浸出”过程中生成了FeSO4,“净化除杂”时加入H2O2溶液将Fe2+氧化成Fe3+,反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O。根据流程,调节溶液的pH约为5,目的是使Fe3+、Al3+依次转化为Fe(OH)3、Al(OH)3沉淀而除去。
(4)NaBH4中Na+与BH4-间为离子键,BH4-内B原子与H原子间为共价键,NaBH4的电子式为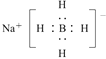 。
。

【题目】下表是元素周期表的一部分
族 周期 | |||||||
① | |||||||
Li | C | ④ | ⑤ | ⑥ | |||
⑦ | ⑧ | ⑨ | ⑩ | ||||
K | ⑾ | ||||||
(1)表中元素______的非金属性最强(填写元素符号,下同);元素______的单质室温下呈液态,它的原子序数是__________
(2)表中元素⑤和⑦、①和⑤均可以组成原子比例为1:1的物质,这两种物质内所含有的相同的化学键是________键(填写“离子键”、“极性共价键”或“非极性共价键”);表中元素⑥⑩⑾氢化物的稳定性由大到小的顺序为:____________________(填写化学式,下同;
(3)表中有一种元素的单质可作为半导体材料,它在元素周期表中的位置是____________;用电子式表示表中⑧⑩两元素形成化合物的过程____________。

