题目内容
【题目】下列实验能达到相应目的是( )
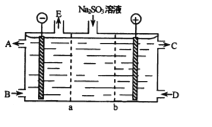
选项 | A | B | C | D |
实验 过程 |
|
|
|
|
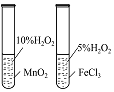
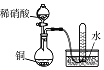
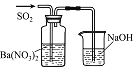
实验 目的 | 将乙二醇(HOCH2CH2OH)转化为乙二酸(H2C2O4) | 比较氯化铁和二氧化锰对H2O2分解反应的催化效果 | 证明稀硝酸与铜反应时表现出氧化性 | 用SO2与Ba(NO3)2反应获得BaSO3沉淀 |
A. A B. B C. C D. D
【答案】C
【解析】A、酸性KMnO4溶液将乙二醇(HOCH2CH2OH)氧化为CO2,故A错误;B、比较氯化铁和二氧化锰对H2O2分解反应的催化效果,H2O2的浓度必须相同,故B错误;C、稀硝酸与铜反应,收集到NO气体,表现出氧化性,故C正确;D、酸性条件下,NO3―能将SO2氧化成SO42―,也生成BaSO4沉淀,故D错误;故选C。

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目