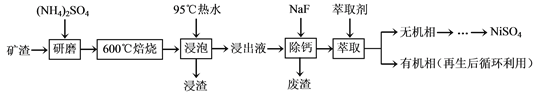
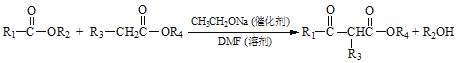
题目内容
【题目】下列有关说法中正确的是
A.某温度时的混合溶液中c(H+)=![]() mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
B.由水电离出的c(H+)=10-12mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存
C.已知Ksp(AgCl)=1.56×10-10, Ksp(Ag2CrO4)=9.0×10-12。向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
D.常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
【答案】A
【解析】
试题分析:
A.某温度时的混合溶液中c(H+)=![]() molL-1,则c(OH-)=
molL-1,则c(OH-)=![]() molL-1=c(H+)=
molL-1=c(H+)=![]() mol/L,溶液呈中性,故A正确;B.由水电离出的c(H+)=10-12molL-1的溶液中存在大量氢离子或氢氧根离子,HCO3-与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故B错误;C.析出沉淀时,AgCl溶液中c(Ag+)=
mol/L,溶液呈中性,故A正确;B.由水电离出的c(H+)=10-12molL-1的溶液中存在大量氢离子或氢氧根离子,HCO3-与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故B错误;C.析出沉淀时,AgCl溶液中c(Ag+)=![]() =
=![]() mol/L=1.56×10-8mol/L,Ag2CrO4溶液中c(Ag+)=
mol/L=1.56×10-8mol/L,Ag2CrO4溶液中c(Ag+)=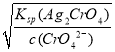 =
=![]() mol/L=3×10-5,c(Ag+)越小,则越先生成沉淀,所以种阴离子产生沉淀的先后顺序为Cl-、CrO42-,即Cl-先产生沉淀,故C错误;D.常温下pH=7的CH3COOH和NaOH混合溶液中,c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(CH3COO-),故D错误;故选A。
mol/L=3×10-5,c(Ag+)越小,则越先生成沉淀,所以种阴离子产生沉淀的先后顺序为Cl-、CrO42-,即Cl-先产生沉淀,故C错误;D.常温下pH=7的CH3COOH和NaOH混合溶液中,c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(CH3COO-),故D错误;故选A。

练习册系列答案
相关题目