题目内容
6.下列排列顺序错误的是( )| A. | 酸性:H4SiO4<H3PO4<H2SO4<HClO4 | B. | 碱性:Ca(OH)2>Mg(OH)2>Al(OH)3 | ||
| C. | 氢化物的稳定性:SiH4>H2S>H2O>HF | D. | 原子半径:F<O<S<Na |
分析 A.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小.
解答 解:A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P>Si,所以酸性H4SiO4<H3PO4<H2SO4<HClO4,故A正确;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性Ca>Mg>Al,所以碱性:Ca(OH)2>Mg(OH)2>Al(OH)3,故B正确;
C.元素的非金属性越强,其氢化物的稳定性越强,非金属性F>O>S>Si,所以氢化物的稳定性SiH4<H2S<H2O<HF,故C错误;
D.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径F<O<S<Na,故D正确;
故选C.
点评 本题考查元素周期律,侧重考查金属性、非金属性强弱判断及原子半径大小比较,为高频考点,知道非金属、金属性强弱与得失电子难易程度有关,与得失电子多少无关,为易错题.

练习册系列答案
相关题目
14.海水是宝贵的自然资源,将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一.
(1)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收,这样做的目的是使Br2富集;碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收0.15mol Br2时,转移的电子为0.25mol.
(2)海水提镁的一段工艺流程如图:
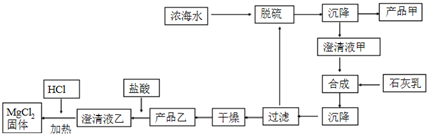
浓海水的主要成分如下:
①该工艺过程中,脱硫阶段主要的离子方程式为Ca2++SO42-=CaSO4↓,加入石灰乳时所发生的离子方程式是Mg2++Ca(OH)2=Mg(OH)2↓+Ca2+
②产品乙的化学式为Mg(OH)2,1L浓海水最多可得到产品乙的质量是69.9g.
(1)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收,这样做的目的是使Br2富集;碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收0.15mol Br2时,转移的电子为0.25mol.
(2)海水提镁的一段工艺流程如图:

浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
②产品乙的化学式为Mg(OH)2,1L浓海水最多可得到产品乙的质量是69.9g.
1.生活中遇到的某些问题,常常涉及于化学知识.下列各项叙述不正确的是( )
| A. | 鱼虾放久了会产生不愉快的腥臭气味,应当用水冲洗,并在烹调时加入少量食醋 | |
| B. | 聚乙烯塑料制品是非环境友好材料,不应制造和使用这类合成材料 | |
| C. | 被蜂蚁蜇咬会感到疼痛难忍,这是蜂蚁咬人时将甲酸注入人体的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| D. | 医用酒精可用于皮肤消毒,其原因在于可以使蛋白质发生变性 |
15.某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列叙述正确的是( )
| A. | 用pH试纸测得该消毒液的pH约为12 | |
| B. | 该消毒液中,Fe3+、K+、NO${\;}_{3}^{-}$、CH3CHO可以大量共存 | |
| C. | 向该消毒液中滴入少量Na2SO3溶液,反应的离子方程为:SO${\;}_{3}^{2-}$+ClO-=Cl-+SO${\;}_{4}^{2-}$ | |
| D. | 向该消毒液中加入浓盐酸,每产生1mol Cl2,转移电子数约为2×6.02×1023 |
19.硅烷是一类最简单的有机硅化合物,其分子组成与烷烃相似,下列说法中错误的是( )
| A. | 硅烷的分子通式为SinH2n+2 | B. | 甲硅烷燃烧生成二氧化硅和水 | ||
| C. | 甲硅烷的密度大于甲烷 | D. | 甲硅烷的热稳定性强于甲烷 |

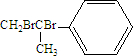 ,化合物Ⅱ完全燃烧消耗O211.5 mol.
,化合物Ⅱ完全燃烧消耗O211.5 mol.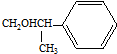 .化合物Ⅳ与新制Cu(OH)2反应的化学方程式
.化合物Ⅳ与新制Cu(OH)2反应的化学方程式 .
.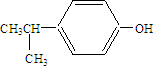 .
.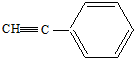 能发生类似反应①的反应经两步生成化合物Ⅶ,Ⅶ的结构简式为
能发生类似反应①的反应经两步生成化合物Ⅶ,Ⅶ的结构简式为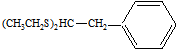 .
.