��Ŀ����
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]X��Y��Z��W��R���ֶ����ڷǽ���Ԫ��ԭ��������������X��Y��Z��WΪͬ����Ԫ����δ�ɶԵ�����֮��Ϊ1:2:3:2��R��Zͬ���塣��ش��������⣺
��1��Z�Ļ�̬ԭ�ӵļ۲�����Ų�ͼΪ______________________________��
��2��Z��W��R ����Ԫ�صĵ縺���ɴ�С��˳��Ϊ_____________����Ԫ�ط��ű�ʾ����
��3��W�ij����⻯�������ļ���С��HF����ļ��ܣ���W�ij����⻯�ﳣ����ΪҺ̬��HF������Ϊ��̬��ԭ����_______________________________��
��4��ij�ַ���ʽΪY4Z4W8�����ʣ���������ͬ��ԭ�ӵĻ�ѧ������ȫ��ͬ������̼̼˫������һ��������ǿ��ըҩ�������֪��ṹ��ʽΪ_________________________��
��5��XR��һ����ĥ���ϣ�����X�����廯���R�����廯���ڸ������������ķ�Χ�кϳɡ�
��X�����廯�������Xԭ�ӵ��ӻ���ʽΪ_______________��R�����廯����ӵĿռ乹�͵�����Ϊ_____________________��
�ںϳ�XR�Ļ�ѧ����ʽΪ_____________________��
��6��Y��W�γɵ�ij�ֳ���������ľ�����ͼ�� �þ����з��ӵ���λ��Ϊ__________________�����������ⳤΪa nm�������ӵ�������ֵΪNA��������ܶ�Ϊ______g/cm3��
�þ����з��ӵ���λ��Ϊ__________________�����������ⳤΪa nm�������ӵ�������ֵΪNA��������ܶ�Ϊ______g/cm3��
���𰸡� 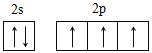 O>N>P ÿ��H2Oƽ���γɵ������Ŀ��ÿ��HFƽ���γɵ������Ŀ��
O>N>P ÿ��H2Oƽ���γɵ������Ŀ��ÿ��HFƽ���γɵ������Ŀ�� 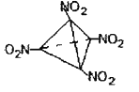 sp2�ӻ� ������ BBr3��PBr3��3H2
sp2�ӻ� ������ BBr3��PBr3��3H2![]() BP��6HBr 12
BP��6HBr 12 ![]()
����������1������֪X��Y��Z��W��R���ֶ����ڷǽ���Ԫ��ԭ��������������X��Y��Z��WΪͬ����Ԫ����δ�ɶԵ�����֮��Ϊ1:2:3:2��R��Zͬ�����Ƴ�XΪB, YΪC��ZΪN��WΪO��RΪP����1��ZΪN���̬ԭ�ӵļ۲�����Ų�ͼΪ. 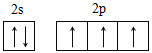
��2����ΪZΪN��WΪO��RΪP������Ԫ�طǽ�����O>N>P���ǽ�����Խǿ���縺��Խ����������Ԫ�صĵ縺���ɴ�С��˳��ΪO>N>P���𰸣�O>N>P��
��3��W�ij����⻯��ΪH2O,ÿ���������γ������������ÿ��HF����ֻ���γ�һ�������������ȻH2O����ļ���С��HF����ļ��ܣ���ˮ������ΪҺ̬��HF������Ϊ��̬���𰸣�ÿ��H2Oƽ���γɵ������Ŀ��ÿ��HFƽ���γɵ������Ŀ����
��4��Y4Z4W8�ķ���ʽΪC4N4O8,��������ͬ��ԭ�ӵĻ�ѧ������ȫ��ͬ������̼̼˫��,��һ��������ǿ��ըҩ������֪��ṹ��ʽΪ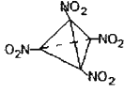 ��
��
��5��XR �ķ���ʽΪBP,��һ����ĥ���ϣ����ɺ�R�����廯��PBr3�ڸ������������ķ�Χ�кϳɡ�
��X�����廯�����ʽBBr3������Xԭ�ӵ��ӻ���ʽΪsp2�ӻ���R�����廯�����ʽPBr3�Ͱ����Ŀռ乹�����ƣ�����R�����廯�����ʽPBr3�Ŀռ乹��Ϊ�����Ρ�
��XR �ķ���ʽΪBP, R�����廯��PBr3�����Ժϳ�XR�Ļ�ѧ����ʽΪ��BBr3��PBr3��3H2![]() BP��6HBr ��
BP��6HBr ��
��6��Y ��W�γɵ�ij�ֳ���������ľ�����ͼ���þ����з��ӵ���λ��Ϊ12 �����������ⳤΪa nm�������ӵ�������ֵΪNA��������ܶ�Ϊ(9). ![]() g/cm3��
g/cm3��
����ͼ�ѱ�����

 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�





