题目内容
【题目】一定条件下,CH4和CO2都能与H2O形成笼状结构的水合物晶体,CH4与H2O形成的水合物俗称“可燃冰”。
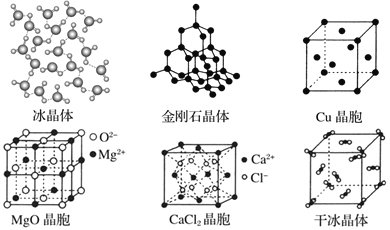
(1)“可燃冰”晶体中平均每46个H2O分子构建8个笼,其中6个笼分别容纳1个CH4分子,另外2个笼分别容纳1个H2O分子,则“可燃冰”平均组成可表示为________(填化学式)。
(2)已知:
CO2(g)+nH2O(l)=CO2·nH2O(s) △H=-57.98kJ·moI-1
CH4(g)+nH2O(l)=CH4·nH2O(s) △H=-54.49kJ·mol-1
反应CO2(g)+CH4·nH2O(s)=CH4(g)+CO2·nH2O(s)的△H=________kJ·mol-1
(3)科学家提出用CO2“置换”CH4开采海底“可燃冰”的设想,提出该设想的理论依据是________。
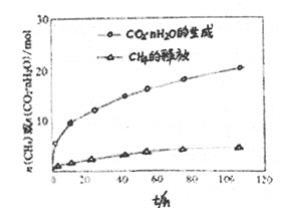
(4)图中显示,CO2·nH2O的生产速率明显大于 CH4·nH2O释放出的速率,其原因是________。
(5)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。
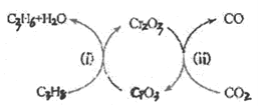
①反应(i)的化学方程式为________。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是________。
【答案】CH4·8H2O -3.49 CO2置换 CH4.nH2O(s)的反应△H<0,在一定温度下可自发进行 CO2·nH2O除置换反应生成外,还存在CO2与H2O结生成CO2·nH2O的反应 3C3H8+2CrO3 3C3H6+Cr2O3+3H2O 碳与CO2反应生成CO,脱离催化剂表面
3C3H6+Cr2O3+3H2O 碳与CO2反应生成CO,脱离催化剂表面
【解析】
(1)根据“可燃冰”的晶体结构得到化学式;
(2)由盖斯定律计算;
(3)根据ΔG=ΔH-TΔS<0,反应可自发进行进行判断;
(5)①反应ⅰ中反应物为C3H8和CrO3,生成物为C3H6、H2O和Cr2O3;
②由于C能与CO2反应生成CO进行解释。
(1)由“可燃冰”的晶体结构可知,一个“可燃冰”晶体结构中含有6个CH4分子和48个H2O分子,因此其平均组成可表示是为CH4·8H2O;
(2)由盖斯定律可得,反应“CO2(g)+CH4·nH2O(s)=CH4(g)+CO2·nH2O(s)”的反应热ΔH=(-57.98kJ/mol)-(-54.94kJ/mol)=-3.49kJ/mol;
(3)由于该反应的ΔH<0,因此在一定条件下,可满足ΔH-TΔS<0,反应可自发进行,因此可用CO2置换CH4开采海底“可燃冰”;
(4)由于CO2能与H2O反应生成CO2·nH2O,因此CO2·nH2O的生成速率明显大于CH4·nH2O的释放速率;
(5)①由反应机理图可知,反应ⅰ中反应物为C3H8和CrO3,生成物为C3H6、H2O和Cr2O3,因此该反应的化学方程式为:3C3H8+2CrO3=3C3H6+Cr2O3+3H2O;
②由于C能与CO2反应生成CO,因此该工艺可以有效消除催化剂表面的积炭,维持催化剂的活性。

【题目】(1)Ⅰ.太阳能、风能发电逐渐得到广泛应用,在发电系统中安装储能装置有助于持续稳定供电,其构造的简化图如下

下列说法中,不正确的是________ (填字母序号)
a.太阳能、风能都是清洁能源
b.太阳能电池组实现了太阳能到电能的转化
c.控制系统能够控制储能系统是充电还是放电
d.阳光或风力充足时,储能系统实现由化学能到电能的转化
(2)全钒液流电池是具有发展前景的、用作储能系统的蓄电池。已知放电时V2+发生氧化反应,则放电时电极A的电极反应式为________ 。
(3)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含有Al3+, Fe3+)等进行综合处理可实现钒资源的回收利用,流程如下:

已知溶液pH范围不同时,钒的存在形式如下表所示
钒的化合价 | pH<2 | pH>11 |
+4价 | VO2+, VO(OH)+ | VO(OH)3- |
+5价 | VO2+ | VO43- |
①加入NaOH调节溶液pH至13时,沉淀1达最大量,并由灰白色转变为红褐色,用化学用语表示加入NaOH后涉及到氧化物还原反应的化学反应方程式为________。
②向碱性的滤液1(V的化合价为+4)中加入H2O2的作用是________ 。
(4)Ⅱ.氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。某工厂处理氨氮废水的流程如下:
![]()
Ⅰ中加入NaOH溶液,调pH=11并鼓入大量空气,用离子方程式表示加NaOH溶液的作用是________;鼓入大量空气的目的是________。
(5)Ⅱ中加入适量NaClO溶液,控制pH在6~7,将氨氮转化为无毒物质,过程Ⅱ发生3个反应:
ⅰ.ClO-+H+=HClO
ⅱ.NH4++HClO=NH2Cl+H++H2O(NH2Cl中Cl元素为+1价)
ⅲ. ……
已知:水体中以+1价形式存在的氯元素有消毒杀菌的作用,被称为“余氯”。下图为NaClO加入量与“余氯”含量的关系示意图。其中氨氮含量最低的点是c点。

b点表示的溶液中氮元素的主要存在形式是(用化学式表示) ________;反应ⅲ的化学方程式是________。
(6)Ⅲ中用Na2SO3溶液处理含余氯废水,要求达标废水中剩余Na2SO3的含量小于5mg·L-1。若含余氯废水中NaClO的含量是7.45mg·L-1,则处理10m3含余氯废水,至多添加10%Na2SO3溶液________kg(溶液体积变化忽略不计)。