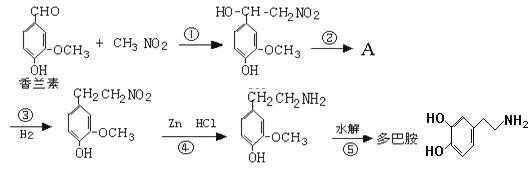
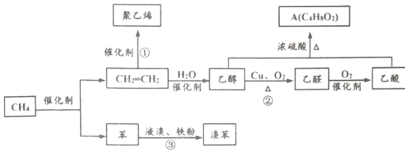
题目内容
【题目】锌及锌的化合物应用广泛。例如,测定铜合金中的铅、锌时要利用锌配离子的下列反应:
[Zn(CN)4]2-+4HCHO+4H2O==Zn2++4HOCH2CN+4OH-,回答下列问题:
(1)基态Zn2+的电子排布式为_____________,基态 C原子核外电子占据_____个不同原子轨道。
(2)C、N、O三种元素的第一电离能由大到小的顺序为___________,HOCH2CN分子中含有的σ键与π键数目之比为_________。
(3)HCHO分子中碳原子轨道的杂化类型是________,福尔马林是HCHO的水溶液,HCHO极易与水互溶的主要原因是_________________________。
(4)[Zn(CN)4]2-中Zn2+与CN-之间的化学键称为_________,提供孤电子对的成键原子是________。
(5)Zn与S形成某种化合物的晶胞如图所示。
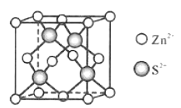
①Zn2+填入S2-组成的___________空隙中;
②已知晶体密度为d g/cm3,该晶胞的边长表达式为______pm(写计算表达式)。
【答案】1s22s22p63s23p63d10(或[Ar]3d10) 4 N>O>C 3:1 sp2 HCHO与水分子间存在氢键 配位键 C 正四面体 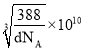
【解析】
(1)Zn位于周期表中第4周期第ⅡB族,C的基态核外电子排布式为1s22s22p2;
(2)C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,据此答题,单键为σ键,三键中一根为σ键,两根为π键;
(3)利用甲醛中的成键来分析碳原子的杂化类型,HCHO极易与水互溶,考虑形成氢键;
(4)含有空轨道和含有孤电子对的原子之间易形成配位键,提供孤电子对的成键原子是C原子;
(5)①ZnS和金刚石晶胞的相似性,根据立体几何分析Zn2+在S2-中的填隙方式;
②根据晶体密度公式d=![]() 计算,其中z为一个晶胞的粒子数,Mr为一个粒子的相对质量,V为一个晶胞的体积。
计算,其中z为一个晶胞的粒子数,Mr为一个粒子的相对质量,V为一个晶胞的体积。
(1)Zn位于周期表中第4周期第ⅡB族,则其基态核外电子排布式为:[Ar]3d10;C的基态核外电子排布式为1s22s22p2,则轨道表达式为![]() ,占据4个不同的原子轨道;
,占据4个不同的原子轨道;
(2)C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C;单键为σ键,三键中一根为σ键,两根为π键,HOCH2CN分子中含有的σ键有6个,含有π键数目为2,所以含有的σ键与π键数目之比为3:1;
(3)甲醛分子中含有碳氧双键,1个甲醛分子中含有2个碳氢σ键,1个碳氧σ键,共有3个σ键,则碳原子轨道的杂化类型为sp2杂化,因甲醛中碳原子采取sp2杂化;福尔马林是HCHO的水溶液,HCHO极易与水互溶是因为HCHO与水分子间存在氢键;
(4)含有空轨道和含有孤电子对的原子之间易形成配位键,Zn2+提供空轨道、CN-中C原子提供孤电子对而形成配位键,提供孤电子对的成键原子是C原子;
(5)①ZnS和金刚石晶胞的相似性,S2-形成的是正四面体结构,则Zn2+填在了S2+形成的正四面体空隙中;
②取1mol晶胞,则有NA个晶胞,设晶胞参数为acm,则一个晶胞的体积为V=a3cm3,对于立方晶胞,顶点粒子占![]() ,面心粒子占
,面心粒子占![]() ,内部粒子为整个晶胞所有,则一个ZnS晶胞中,含有Zn的数目为8×
,内部粒子为整个晶胞所有,则一个ZnS晶胞中,含有Zn的数目为8×![]() +6×
+6×![]() =4,含有S的数目为4,因此1molZnS的质量为m=4×(65+32)g=388g,已知晶体的密度为dg/cm3,则有d=
=4,含有S的数目为4,因此1molZnS的质量为m=4×(65+32)g=388g,已知晶体的密度为dg/cm3,则有d=![]() =
=![]() g/cm3,解得:a=
g/cm3,解得:a=![]() cm=
cm=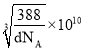 pm。
pm。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验的现象与结论相对应的是
A | B | C | D | |
实验 |
|
|
|
|
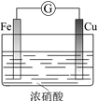
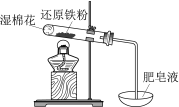
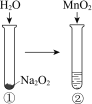
现象 | 电流计指针向右偏(电子由Fe转移到Cu),片刻后向左偏 | 加热一段时间后溶液蓝色褪去 | 加热,肥皂液中产生无色气泡 | ①和②中均迅速产生大量气泡 |
结论 | 铁片作负极,片刻后铜片作负极 | 淀粉在酸性条件下水解,产物是葡萄糖 | 铁粉与水蒸气反应生成H2 | MnO2一定是②中反应的催化剂 |
A.AB.BC.CD.D
【题目】下表列出了5种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ |
(1)①的元素符号是_______,⑤的原子结构示意图是__________;
(2)以上元素中,非金属性最强的是___________(填元素符号);
(3)④元素的最高价氧化物对应的水化物呈______性(填“酸”或“碱”或“两”);
(4)③④⑤三种元素按原子半径由大到小的顺序是______(填元素符号);
(5)元素①与元素②的单质氧化性较强的是________(填化学式)。;
(6)元素④的最高价氧化物与元素③的最高价氧化物对应的水化物相互反应的化学方程式__。
【题目】钠和钾是极活泼的金属元素,钠和钾及化合物在生产和生活中有广泛的应用。
(1)写出两种可以食用的含钠化合物的化学式:________。将0.01 mol下列物质(①Na2O2;②Na2O;③Na2CO3;④NaCl)分别加入100 mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度由大到小的顺序是(溶液体积变化忽略不计)_______。
(2)由于钾比钠更活泼,制备K2O一般是用单质钾还原对应的过氧化物、硝酸盐或亚硝酸盐,试写出用钾与硝酸钾反应制取K2O的化学方程式(还有一种单质生成):______________________。K2O2也有强氧化性,试写出其与SO2发生反应的化学方程式:_______________________。
(3)某学生用Na2CO3和 KHCO3组成的某混合物进行实验,测得如表数据(盐酸的物质的量浓度相等且不考虑HCl的挥发)
实验序号 | ① | ② | ③ | ④ |
盐酸体积/mL | 50 | 50 | 50 | 50 |
固体质量/g | 3.06 | 6.12 | 9.18 | 12.24 |
生成气体体积/L(标况) | 0.672 | 1.344 | 1.568 | 1.344 |
根据数据计算所用盐酸的物质的量浓度为__________,原混合物样品中n(Na2CO3)∶n(KHCO3)=_________。