题目内容
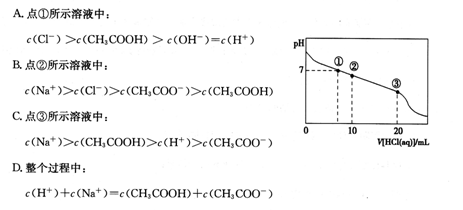
常温下,向20.00 mL 0.1000 mol·L-1CH3COONa溶液中逐滴加入0.1000 mol·L-1盐酸,混合溶液的pH与所加盐酸体积的关系如图所示。下列说法正确的是

C
试题分析:A。在①点溶液的pH=7,c(H+)=c(OH-),CH3COONa+HCl=CH3COOH+NaCl,c(CH3COOH)= c(NaCl)=c(Cl-),盐的电离远大于弱电解质的电离。因此c(Cl-)=c(CH3COOH) >c(H+)=c(OH-) .错误。B.在②所示的溶液中,发生反应CH3COONa+HCl=CH3COOH+NaCl,得到的溶液中n(NaCl)= n(CH3COOH)= n(CH3COONa)。.因为此溶液显酸性,所以CH3COOH的电离作用大于CH3COO-的水解作用。因此,c(Na+)>c(CH3COO-)> c(Cl-)> c(CH3COOH).错误。C.在点③所示的溶液中,恰好完全发生反应CH3COONa + HCl=CH3COOH+NaCl,得到的是CH3COOH与NaCl的混合溶液,由于醋酸是弱酸,发生电离作用,所以c(Na+)>c(CH3COOH),在溶液中除了存在酸的电离,还存在水的电离作用,因此c(H+)> c(CH3COO-),但是酸或水的电离作用是微弱的,所以c(CH3COOH) > c(H+)。所以在溶液中的离子的浓度关系为:c(Na+)>c(CH3COOH) > c(H+)> c(CH3COO-)。正确。D.在整个过程中,根据电荷守恒可得c(H+)+ c(Na+)= c(Cl-)+c(CH3CO-),根据物料守恒可得c(Na+)= c(CH3CO-)+ c(CH3COOH)。错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目