��Ŀ����
25��ʱ������ĵ���ƽ�ⳣ�����±������б����������
A��CN��+H2O+CO2��HCN+HCO3��
B����ͬ�¶�ʱ����Ũ����ͬ��Һ��pH��ϵ��Na2CO3> NaCN > CH3COONa
C��������������ʵ���Ũ�ȵ�CH3COOH��Na2CO3��Ϸ�Ӧ��
c(Na+)>c(HCO3��)>c(CH3COO��)>c(OH��)>c(H��)
D��amol/L HCN��bmol/L NaOH����������Һc(Na+)>c(CN��������aһ��С��b
| ���� | CH3COOH | HCN | H2CO3 |
| K | 1.8��10��5 | 4.9��10��10 | K1=4.3��10��7 K2=5.6��10��11 |
B����ͬ�¶�ʱ����Ũ����ͬ��Һ��pH��ϵ��Na2CO3> NaCN > CH3COONa
C��������������ʵ���Ũ�ȵ�CH3COOH��Na2CO3��Ϸ�Ӧ��
c(Na+)>c(HCO3��)>c(CH3COO��)>c(OH��)>c(H��)
D��amol/L HCN��bmol/L NaOH����������Һc(Na+)>c(CN��������aһ��С��b
CD
���������A��̼������ǿ��HCN ����HCO3-��������HCN����ȷ��B���������ʶ�Ӧ�ἰǿ��ΪΪHCO3-��HCN ��CH3COOH����ˮ��̶�ΪNa2CO3> NaCN > CH3COONa��ˮ��̶�Խ����Խǿ����ȷ��C�����ɵ�Ũ�ȵĴ����ƺ�̼�����ƻ����Һ����������ǿ��̼�ᣬ��̼������ˮ��̶ȴ��ڴ����ƣ�����c(Na+)> c(CH3COO��) > c(HCO3��) >c(OH��)>c(H��)������D������ǡ�÷�Ӧʱ����NaCN��ˮ��CN��ʹ��c(Na+)>c(CN�������������ͬ����c(Na+)>c(CN��������a��b������

��ϰ��ϵ�д�
�����Ŀ
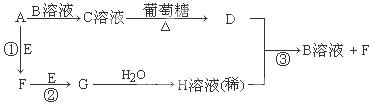
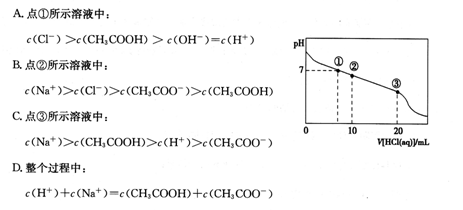
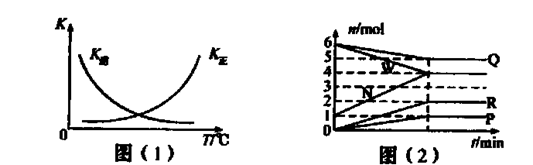
 2G��g��������
2G��g��������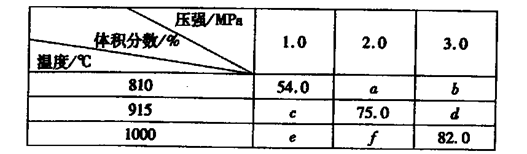
 H++HS-��HS-
H++HS-��HS-