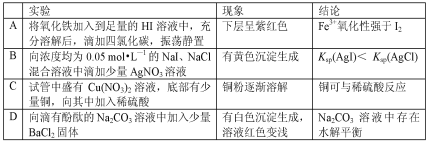
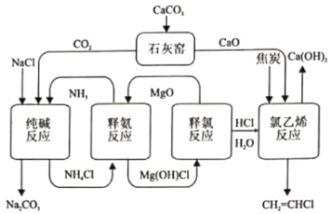
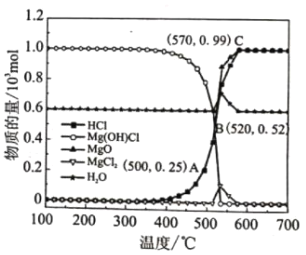
题目内容
【题目】用如图实验装置(夹持仪器己略去)探究铁与浓硫酸的反应,下列实验不合理的是
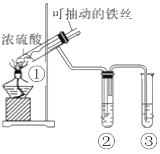
A.上下移动①中的铁丝可控制生成SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认产物中铁元素的价态,向①中加水,观察颜色变化
【答案】D
【解析】
A、当铁丝与浓硫酸接触时才能反应,当往上抽动铁丝时,铁丝与硫酸不接触,反应停止,故可通过上下移动①中铁丝可控制SO2的量,故A不符合题意;
B、二氧化硫能和有色物质反应生成无色物质而具有漂白性,二氧化硫能使品红溶液褪色,则可以用品红溶液检验二氧化硫,故B不符合题意;
C、二氧化硫有毒,不能直接排空,但二氧化硫属于酸性氧化物,能和碱反应生成盐和水,所以可以用NaOH溶液处理尾气,故C不符合题意;
D、实验中,铁丝与过量浓硫酸的反应生成硫酸铁,试管中还含有过量的浓硫酸,为确认硫酸铁生成,应用胶头滴管将试管1中的液体取出少量,滴入水中,观察溶液颜色,若溶液显棕黄色,证明有硫酸铁生成,反之则无,而不应将水加入过量的浓硫酸中,否则易产生暴沸现象,故D符合题意;
故选D。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案【题目】实验室用乙醇、浓磷酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):
H3PO4(浓)+NaBr![]() NaH2PO4+HBr、CH3CH2OH+HBr
NaH2PO4+HBr、CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
有关数据见下表:
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红色液体 |
密度g/mL | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
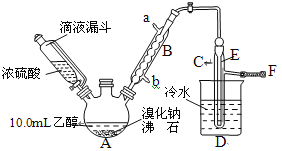
(1)A中放入沸石的作用是___。
(2)仪器B的名称为___,B中进水口为___(填“a”或“b”)口。
(3)实验中用滴液漏斗代替分液漏斗的优点为:___。
(4)制取氢溴酸时,为什么不能用浓H2SO4代替浓磷酸?___(用化学方程式表示)。
(5)将C中的馏出液转入三角烧瓶中,边振荡边逐滴滴入浓H2SO4以除去水等杂质,滴加浓硫酸约1~2mL,使溶液明显分层,再用分液漏斗分去硫酸层,将经硫酸处理后的溴乙烷转入蒸馏瓶,水浴加热蒸馏,收集到35~40℃馏分约10.0g,从乙醇的角度考虑,本实验所得溴乙烷的产率是___。
【题目】某兴趣小组在实验室用乙醇、浓硫酸和溴化钠和水混合反应来制备溴乙烷,并探究溴乙烷的性质。
有关数据见下表:
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红色液体 |
密度/(g·cm3) | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
一.溴乙烷的制备
反应原理和实验装置如下(加热装置、夹持装置均省略):
H2SO4+NaBr![]() NaHSO4+HBr↑ CH3CH2OH+HBr
NaHSO4+HBr↑ CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
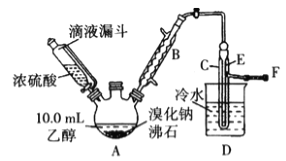
(1)图中沸石的作用为_____________。若图甲中A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应生成了________;F连接导管通入稀NaOH溶液中,其目的主要是吸收_________等防止污染空气;导管E的末端须低于D中烧杯内的水面,其目的是_______________________________。
(2)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g。从乙醇的角度考虑,本实验所得溴乙烷的产率是_____________(保留3位有效数字)。
二.溴乙烷性质的探究
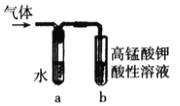
用如图实验装置验证溴乙烷的性质:
(3)在乙中试管内加入10mL6mol·L-1NaOH溶液和2mL溴乙烷,振荡、静置,液体分层,水浴加热。该过程中的化学方程式为_______________________________________,证明溴乙烷与NaOH溶液已反应完全的现象是________________________________。
(4)若将乙中试管里的NaOH溶液换成NaOH乙醇溶液,为证明产物为乙烯,将生成的气体通入如图装置。a试管中的水的作用是________________;若无a试管,将生成的气体直接通入b试管中,则b中的试剂可以为______________。