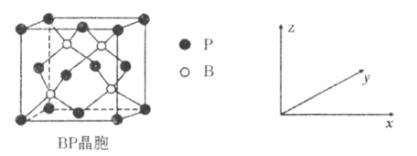
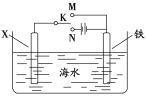
��Ŀ����
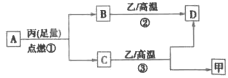
����Ŀ����ͼ��ʾ���ס������ص缫���϶���������̼������ش��������⣺
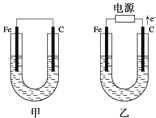
��1���������е������Һ��ΪCuSO4��Һ����Ӧһ��ʱ���
���к�ɫ�����������Ǽ׳��е�___�����ҳ��е�___����
���ҳ��������ĵ缫��Ӧʽ��___��
��2���������е������Һ��Ϊ����NaCl��Һ��
��д���ҳ����ܷ�Ӧ�����ӷ���ʽ___��
�ڼ׳���̼���ϵ缫��Ӧʽ��___���ҳ�̼���ϵ缫��Ӧ����___���������Ӧ����ԭ��Ӧ������
�۽�ʪ���KI������ֽ�����ҳ�̼��������������ֽ��������Ӧ�Ļ�ѧ����ʽΪ___��
�����ҳ�ת��0.02mole����ֹͣʵ�飬���е������Һ�����200mL������Һ��Ͼ��Ⱥ��pH��___��
���𰸡�̼ �� 4OH����4e����O2��+2H2O 2Cl��+2H2O![]() Cl2��+H2��+2OH�� 2H2O+O2+4e���T4OH�� ������Ӧ 2KI+Cl2��I2+2KCl 13
Cl2��+H2��+2OH�� 2H2O+O2+4e���T4OH�� ������Ӧ 2KI+Cl2��I2+2KCl 13
��������
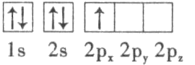
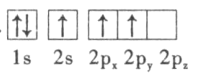
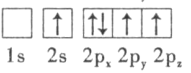
��1���ټ׳�Ϊԭ��أ�ԭ����л��ý���������������������Ӧ��̼������������Cu�������ҳ�Ϊ���أ����·���������Դ����������̼��Ϊ�������ų��������������缫�Ϸ�����ԭ��Ӧ��Cu�������ʴ�Ϊ��̼������
����Ϊ���أ��ɵ��������֪��FeΪ������ͭ���ӵõ���������Cu���������������������ӷŵ磬�缫��ӦΪ4OH����4e����O2��+2H2O���ʴ�Ϊ��4OH����4e����O2��+2H2O��
��2�������������ҺΪ�����Ȼ�����Һ�����ҳؾ����ö��Ե缫Ϊ��������Ȼ�����Һ������ʽΪ��2Cl��+2H2O![]() Cl2��+H2��+2OH�����ʴ�Ϊ��2Cl��+2H2O
Cl2��+H2��+2OH�����ʴ�Ϊ��2Cl��+2H2O![]() Cl2��+H2��+2OH����
Cl2��+H2��+2OH����
�ڼ׳���̼��Ϊ�����������������õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ��2H2O+O2+4e���T4OH�����ҳ���̼��Ϊ��������������������Ӧ���ʴ�Ϊ��2H2O+O2+4e���T4OH����������Ӧ��
�۽�ʪ���KI������ֽ�����ҳ�ʯī�缫������������ֽ��������ʯī�缫��������ʧ�������������������͵����ӷ�Ӧ���ɵⵥ�ʣ�����������Һ����ɫ����Ӧ����ʽΪ��2KI+Cl2��I2+2KCl���ʴ�Ϊ��2KI+Cl2��I2+2KCl��
�ܵ���Ȼ�����Һ�ķ���ʽΪ��2NaCl+2H2O![]() Cl2��+H2��+2NaOH���ҳ�ת��0.02mole��������0.02mol���������ƣ���������NaOH��Һ�����ʵ���Ũ��c��
Cl2��+H2��+2NaOH���ҳ�ת��0.02mole��������0.02mol���������ƣ���������NaOH��Һ�����ʵ���Ũ��c��![]() ��
��![]() ��0.1mol/L��������Һ��������Ũ�ȣ�
��0.1mol/L��������Һ��������Ũ�ȣ�![]() ��������Һ��pH��13���ʴ�Ϊ��13��
��������Һ��pH��13���ʴ�Ϊ��13��

����Ŀ��ૼ����׳ƿ��ᣬ�㷺Ӧ�������Ϲ�ҵ��ʳƷ��ҵ��Ϳ�ϡ�ҽҩ�����ϵȡ���ૼ�ȩ�Ʊ�ૼ������Ʒૼ״���ԭ��Ϊ��
��Ӧ1��![]() +NaOH
+NaOH![]()
![]() ��H��0
��H��0
��Ӧ2��![]() +HCl
+HCl![]()
![]() +HCl
+HCl
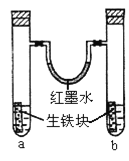
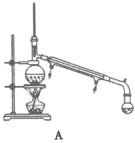
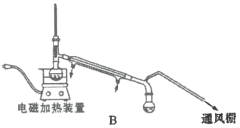
ij�о���ѧϰС��������ͼװ���Ʊ�ૼ����ʵ���������£�
��֪�������ѣ�![]() ���е�34.6�����������ж�����ʹ��ʧȥ֪����
���е�34.6�����������ж�����ʹ��ʧȥ֪����
����Ҫ�Լ���������������£�
�Լ� | ��Է������� | �ܶ�/ | �۵�/�� | �е�/�� | �ܽ��� |
ૼ�ȩ | 96 | 1.16 |
| 161.7 | ����ˮ���������Ҵ������ѡ� |
ૼ״� | 98 | 1.13 |
| 171.0 | ����ˮ���ɻ������Ҵ������ѡ� |
ૼ��� | 112 | - | 129.5 | 231.0 | ������ˮ������ˮ���ܽ�Ƚϴ��������Ҵ������ѡ� |
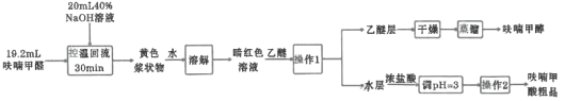
��ش��������⣺
��1�������»�����ʱ����Ʒ�Ӧ�¶�8~12����Ӧ��ȡ�Ŀ��·�ʽ��________��������ƿ���������![]() ��ҺӦ���Ԥ����________���μ�ૼ�ȩʱ��________��
��ҺӦ���Ԥ����________���μ�ૼ�ȩʱ��________��
��2���������»�����ʱ��ֽ�����ܻ�ýϸ߲��ʡ���ԭ����________��
��3��������1��������Ϊ________�����õ��IJ���������Ҫ��________��������2����Ҫ����________��________��
��4����������ʱ������ͼ________������ĸ��ţ�װ�ø��ã�����һװ����ȣ���װ�õ��ŵ��Т�________����________��
��5��ૼ����Ʒ���������õķ�����________�����յõ�����Ʒ9.86g��ૼ���IJ���Ϊ________��