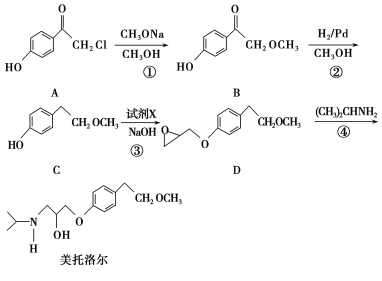
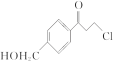
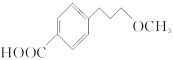
��Ŀ����
����Ŀ������������ȼ�ϵ�أ�SOFC���Թ�����������Ϊ����ʣ��乤��ԭ����ͼ��ʾ�����й��ڹ���ȼ�ϵ�ص��й�˵������ȷ���ǣ�������
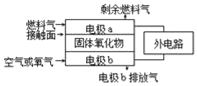
A. ������������������õ����ڵ����ͨ��
B. ������������O2����a����b���ƶ�
C. �缫bΪ��صĸ������缫��ӦʽΪ��O2+4e��=2O2��
D. ����C3H8Ϊȼ��������Ӵ����Ϸ����ķ�ӦΪC3H8��20e��+10O2���T3CO2+4H2O
���𰸡�D
��������A������ԭ��صĹ���ԭ��������ڲ�û�е��ӵ�ͨ����ֻ���������ӵ�ͨ������˹������������������������ͨ�����γɱպϻ�·���ʴ���B�����������ƶ����������������ƶ���ȼ�ϵ����ͨ���������һ��Ϊ������ͨȼ�ϵ�һ��Ϊ���������O2����b��a�ƶ����ʴ���C����������������bΪ�������缫��ӦʽΪO2��4e��=2O2�����ʴ���D��ȼ�ϵ���൱��ȼ�գ�ӦΪ����O2����C3H8��CO2��H2O�����ݻ��ϼ۵ı仯����ʧȥ����20e����C3H8��20e����3CO2��4H2Oǰ�����غ㡢ԭ���غ㣬��˵缫��ӦʽΪ��C3H8 �C 20e- + 10O2- =3CO2 +4H2O������ȷ��

����Ŀ��ij�¶��£��ܱ�������X��Y��Z��W��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����������˵��������ǣ�������
���� | X | Y | Z | W |
��ʼŨ��/molL��1 | 0.5 | 0.6 | 0 | 0 |
ƽ��Ũ��/molL��1 | 0.1 | 0.1 | 0.4 | 0.6 |
A. ��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ80%
B. �÷�Ӧ��ƽ�ⳣ������ʽΪk=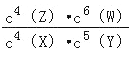
C. ����ѹǿ��ƽ�ⳣ�����䣬��ʹƽ��������Z�ķ����ƶ�
D. �ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
����Ŀ����һ���¶��£�������X������Y��0.16mol����10L�����ܱ������У�������ӦX��g��+Y��g��![]() 2Z��g����H��0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������������˵����ȷ���ǣ�������
2Z��g����H��0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������������˵����ȷ���ǣ�������
t/min | 2 | 4 | 7 | 9 |
n��Y��/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. ���¶��´˷�Ӧ��ƽ�ⳣ��K=1.44
B. �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ�����棩����������
C. �����������䣬�ٳ���0.2molZ��ƽ��ʱX�������������
D. 0��2min��ƽ�������ͣ�Z��=2.0��10��3molL��1min��1