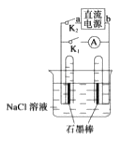
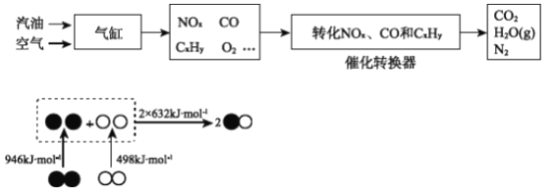
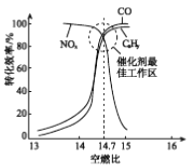
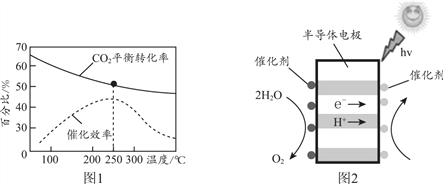
��Ŀ����
����Ŀ�����������Ȼ�ѧ����ʽ�ó��Ľ�����ȷ���ǣ�������
A.��֪NaOH��aq��+HCl��aq��=NaCl��aq��+H2O��l����H=��57.3KJ/mol����40gNaOH������ϡ������ȫ��Ӧ���ų���������Ϊ57.3KJ
B.��֪C��s��+O2��g��=CO2��g����H1 C��s��+ ![]() ��g��=CO��g����H2 ���H1����H2
��g��=CO��g����H2 ���H1����H2
C.��֪H2��g��+Cl2��g��=2HCl����H=��184.6KJ/mol����Ӧ��������С��������������
D.��֪P�����ף�s��=P�����ף�s����H��0������ױȺ����ȶ�
���𰸡�B
���������⣺A��NaOH��������ˮ���ȣ����к��ȿ�֪��40gNaOH������ϡ������ȫ��Ӧ���ų�����������57.3KJ����A����
B����ͬ��C����ȫȼ�շų������࣬�ʱ�Ϊ��������ȫȼ��ʱ�ʱ�С����֪��H1����H2����B��ȷ��
C����H2��g��+Cl2��g��=2HCl��H=��184.6KJ/mol����֪��Ӧ����������������������������C����
D����P�����ף�s��=P�����ף�s����H��0����֪���������ͣ�����ױȰ����ȶ�����D����
��ѡB��
�����㾫����ͨ��������÷�Ӧ�Ⱥ��ʱ䣬�����ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȼ����Խ����⣮