题目内容
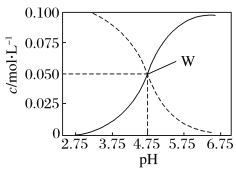
【题目】25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随加入的c(HC2O4-)的变化趋势如图所示。下列说法正确的是( )
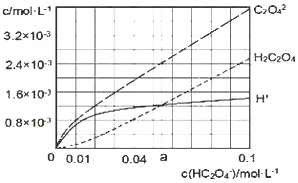
A.当c(HC2O4-)=0.1 mol/L时,c(H+)>c(C2O42-)-c(H2C2O4)
B.当c(HC2O4-)>a mol/L时,c(H+)<c(H2C2O4),HC2O4-的水解程度大于电离程度
C.HC2O4-![]() C2O42-+H+,Ka(HC2O4-)=a
C2O42-+H+,Ka(HC2O4-)=a
D.将0.08 mol/LH2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)>c(H+)>c(OH-)
【答案】A
【解析】
A.根据NaHC2O4溶液中的物料守恒得c(Na+)=c(C2O42-)+c(H2C2O4)+c(HC2O4-);根据电荷守恒可得:c(H+)+c(Na+)=2c(C2O42-)+c(HC2O4-)+c(OH-),二者结合,整理可得:c(H2C2O4)+ c(H+)=c(C2O42-)+c(OH-),则c(H+)=c(C2O42-)+c(OH-)-c(H2C2O4),所以c(H+)>c(C2O42-)-c(H2C2O4),A正确;
B.当c(HC2O4-)>a mol/L时,c(H+)<c(H2C2O4),根据图象可知,当c(HC2O4-)>a mol/L时c(C2O42-)>c(H2C2O4),HC2O4-的水解程度小于电离程度,B错误;
C.Ka(HC2O4-)=a时,c(H+)=c(H2C2O4),由于HC2O4-的电离程度较小,则c(HC2O4-)≈a mol/L,Ka(HC2O4-)=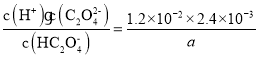 ,草酸的电离平衡常数Ka(H2C2O4)=
,草酸的电离平衡常数Ka(H2C2O4)=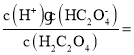 c(HC2O4-)≈a,草酸的第二步电离小于第一步电离,则Ka(HC2O4-)<a,C错误;
c(HC2O4-)≈a,草酸的第二步电离小于第一步电离,则Ka(HC2O4-)<a,C错误;
D.将0.08 mol/LH2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),反应后溶质为0.04 mol/L的NaHC2O4溶液,根据图象可知c(C2O42-)>c(H+)>c(H2C2O4),HC2O4-电离及水解程度都是微弱的,主要是以HC2O4-的形式存在,所以溶液中离子浓度关系正确的为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(H2C2O4)>c(OH-),D错误;
故合理选项是A。