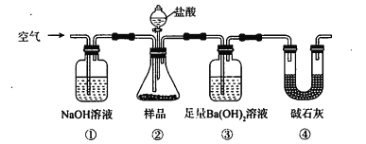
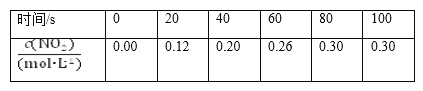
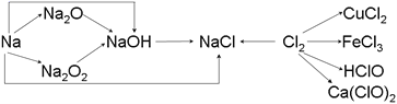
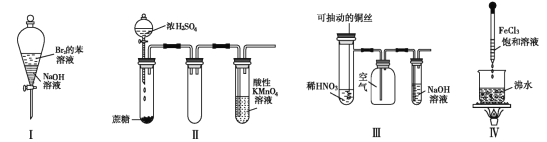
题目内容
【题目】向20 mL NaOH溶液中逐滴加入0.1 mol/L醋酸溶液,滴定曲线如图所示。下列判断正确的是( )

A.在M点,两者恰好反应完全
B.滴定前,酸中c(H+) 等于碱中c(OH﹣)
C.NaOH溶液的物质的量浓度为0.1 mol/L
D.在N点,溶液中的c(CH3COO﹣)=c(CH3COOH)
【答案】C
【解析】
A.NaOH溶液与醋酸恰好反应醋酸钠,醋酸钠是强碱弱酸盐,其水溶液呈碱性,若要使溶液呈中性,酸的物质的量应稍微大些,即醋酸未完全反应,故A错误;
B.NaOH溶液在滴定开始时的pH=13,c(H+)=10-13mol/L,碱中c(OH-)=![]() mol/L=0.1mol/L,醋酸是弱酸,0.1mol/L醋酸溶液中c(H+)小于0.1mol/L,故B错误;
mol/L=0.1mol/L,醋酸是弱酸,0.1mol/L醋酸溶液中c(H+)小于0.1mol/L,故B错误;
C.NaOH溶液在滴定开始时的pH=13,c(H+)=10-13mol/L,碱中c(OH-)=![]() mol/L=0.1mol/L,所以NaOH溶液的物质的量浓度为0.1mol/L,故C正确;
mol/L=0.1mol/L,所以NaOH溶液的物质的量浓度为0.1mol/L,故C正确;
D.在N点溶液中的溶质为同浓度的醋酸和醋酸钠,溶液呈酸性,说明CH3COOH的电离大于CH3COO-的水解,则平衡时c(CH3COO-)>c(CH3COOH),故D错误;
故选C。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4 kJ/mol。实验测得有关数据如下表:
2NH3(g) △H=-92.4 kJ/mol。实验测得有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量a kJ |
② | 2 | 3 | 0 | 放出热量b kJ |
③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是 ( )。
A.达平衡时氨气的体积分数:①>③
B.三个容器内反应的平衡常数:③>①>②
C.放出热量关系:a < b <92.4
D.H2的转化率:①> ②> ③