题目内容
【题目】已知钠、氯及其化合物间有如下转化关系,请按要求填空:
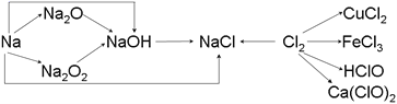
(1)实验室中金属钠通常保存在______中,一小块金属钠投入硫酸铜溶液中反应的离子方程式是____________。
(2)Na2O2常用于呼吸面具中,有关反应的化学方程式为_____________,___________。
(3)Na2O2粉末投入到紫色石蕊试液中,观察到的现象是____________。
(4)工业上用氯气和石灰乳反应制漂白粉,其化学方程式为__________。
【答案】煤油或石蜡油 2Na+2H2O+Cu2+=2Na++H2↑+Cu(OH)2↓ 2Na2O2+2CO2=2Na2CO3+O2 2Na2O2+2H2O=4NaOH+O2↑ 先变蓝后褪色 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
【解析】
(1)钠在空气中易被氧气氧化,钠易与水反应,金属钠的密度大于煤油或石蜡油,所以应该保存在煤油或石蜡油中;一小块金属钠投入硫酸铜溶液中,钠首先与水反应生成氢氧化钠,氢氧化钠接着与硫酸铜反应生成氢氧化铜沉淀,故反应的离子方程式为2Na+2H2O+Cu2+=2Na++H2↑+Cu(OH)2↓;
(2)过氧化钠是淡黄色固体,过氧化钠与二氧化碳、水蒸气反应放出氧气,反应的方程式是2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑;
(3)Na2O2粉末投入到紫色石蕊试液中,过氧化钠与水反应生成氢氧化钠和氧气,氢氧化钠是强碱,能够使紫色石蕊试液变蓝,又因为Na2O2有强氧化性,能够使紫色石蕊试液褪色,故溶液最终变为无色;
(4)工业上用氯气和石灰乳反应生成氯化钙和次氯酸钙,化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。

【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 当容器中气体的密度不变时,该反应达到平衡状态
B. 该反应进行到第3分钟时,逆反应速率小于正反应速率
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4