题目内容
【题目】(10分)Ⅰ.1100 ℃时,体积为2L的恒容容器中发生如下反应:Na2SO4(s)+4H2 (g)![]() Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)
(1)下列能判断反应达到平衡状态的是________。
A.容器内气体压强不再变化
B.H2的体积分数不再变化
C.1 mol H-H键断裂同时2 mol H-O键形成
D.Na2S的质量不再变化
E.υ(正)=υ(逆)
F.容器内气体密度不再变化
(2)若2 min时反应达平衡,此时气体质量增加8 g,则用H2表示该反应的反应速率为: 。
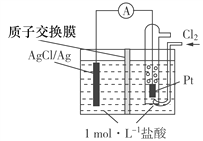
Ⅱ.丙烷燃料电池,以KOH溶液为电解质溶液。
(3)通入丙烷的电极为_____(填“正极”或“负极”),正极的电极反应式为 。
(4)燃料电池的优点________。
(5)若开始时电解质溶液中含KOH的物质的量为0.25 mol,当溶液中K2CO3的物质的量为0.1 mol时,消耗标准状况下丙烷的体积为 mL(保留一位小数)。
【答案】(1)BDEF;(2)0.125 mol/(L·min);(3)负,O2+4e-+2H2O=4OH-;
(4)能量转化率高,环境友好;(5)746.7。
【解析】
试题分析:(1)A、反应前后气体系数之和相等,反应始终压强都相等,不能作为达到平衡的标志,故错误;B、依据化学平衡状态的定义:一定条件下,可逆反应中,当正方向速率和逆反应速率相等,且各组分的浓度不变,这样的状态的成为化学平衡状态,故正确;C、1 mol H-H键断裂同时2 mol H-O键形成 ,都是向正反应方向进行的,不能作为达到平衡的标志,故错误;D、反应向正反应方向进行,Na2S的质量不断增大,当质量不在改变,说明达到平衡了,故正确;E、依据化学平衡状态的定义,故说法正确;F、ρ=m/v,随反应的进行,气体的质量增加,且此容器是恒容,当密度不在改变,说明达到平衡,故正确;(2)气体质量增加8g,消耗氢气4×8/64mol=0.5mol,v(H2)=0.5/(2×2)mol/(L·min)=0.125 mol/(L·min);(3)依据原电池的工作原理,化合价升高的电极作负极,即通入燃料的电极为负极,电极反应式:C3H8+26OH--20e-=3CO32-+17H2O,正极反应:O2+4e-+2H2O=4OH-;(4)燃料电池优点:能量转化率高,环境友好;(5)根据C3H8+26OH--20e-=3CO32-+17H2O,生成0.1molK2CO3,同时消耗丙烷0.1×22.4×103/3mL=746.7mL。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案