题目内容
【题目】I.请根据化学反应与热能的有关知识,填写下列空白:
(1)下列反应中,属于吸热反应的是_________(填数字序号)。
①煅烧石灰石制生石灰 ②燃烧木炭取暖 ③铝粉与氧化铁粉末在高温下反应
④酸碱中和反应 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)已知H2和O2反应放热,且断开1molH-H、1mo1O=O、1molO-H键需吸收的能量分别为Q1kJ、Q2kJ、Q3kJ,由此可以推知下列关系正确的是______(填字母编号)。
A. Q1+ Q2> Q3 B. 2Q1+ Q2<4 Q3 C. Q1+Q2>2Q3 D. 2Q1+Q2<2Q3
II.已知2mol氢气燃烧生成液态水时放出572KJ热量,反应的热化学方程式是2H2(g)+O2(g)=2H2O(l) △H=-572KJ·mol-1。
(3)该反应生成物的能量总和______(填“大于”“小于”或“等于”)反应物的能量总和。
(4)若2mol氢气完全燃烧生成水蒸气,则放出的热量_______(填“>”“<”或“=”)572KJ。
III.(5)已知16g固体硫完全燃烧时放出148.4KJ的热量,写出表示硫的燃烧热的热化学方程式:____________________________________。
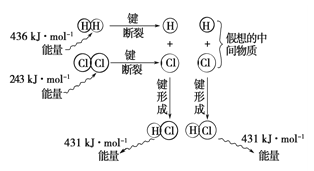
(6)观察下图,计算1molH2与1molCl2反应_______(“吸收”或“释放”)的能量为_________。
【答案】 ① B 小于 < S(s)+O2(g)=SO2(g) △H=-296.8kJ·mol-1 释放 183kJ
【解析】I.(1)煅烧石灰石制生石灰是吸热反应,其余均是放热反应,答案选①;(2)氢气燃烧放热,又因为反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则根据方程式2H2+O2=2H2O可知2Q1+ Q2<4 Q3,答案选B;
II.(3)反应是放热反应,则该反应生成物的能量总和小于反应物的能量总和。(4)由于液态水转化为气态水需要吸热,因此若2mol氢气完全燃烧生成水蒸气,则放出的热量<572kJ。
III.(5)燃烧热是指1mol可燃物完全燃烧生成稳定氧化物时所放出的热量,已知16g固体硫即0.5molS完全燃烧时放出148.4kJ的热量,则表示硫的燃烧热的热化学方程式为S(s)+O2(g)=SO2(g) △H=-296.8kJ·mol-1。(6)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则根据示意图可知该反应的反应热=(436+243-2×431)kJ/mol=-183kJ/mol,所以1molH2与1molCl2反应释放的能量为183kJ。

 阅读快车系列答案
阅读快车系列答案