题目内容
【题目】某原电池装置如图所示,电池总反应为:2Ag+Cl2===2AgCl。下列说法正确的是
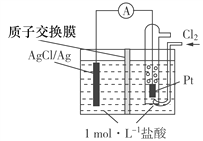
A. 正极反应为AgCl+e-===Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
D. 若用NaCl溶液代替盐酸,则电池总反应随之改变
【答案】C
【解析】A项,由图可知右边铂电极通氯气,故右边电极为正极,电极反应式为Cl2+2e-=2Cl-,A错误;B项,由于质子交换膜只允许H+离子通过,故在右侧溶液中不会有大量白色沉淀生成,B错误;C项,当电路中转移0.01 mol e-时,交换膜左侧产生0.01 mol Ag+与盐酸反应产生AgCl沉淀,同时约有0.01 mol H+通过阳离子交换膜转移到右侧溶液中,故左侧溶液共约0.02 mol离子减少,C正确;D项,若用KCl溶液代替盐酸,参与反应的离子仍为Cl-,故两电极反应及总反应不变,D错误。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目