题目内容
将N2、H2混合气体分别充入甲、乙、丙三个容器中进行合成氨反应,经过一段时间后反应速率为:甲 v(H2)= 3mol·(L·min)-1;乙 v(N2)= 2mol·(L·min)-1;丙 v(NH3)= 1mol·(L·min)-1。在这段时间内三个容器中合成氨的反应速率( )
A.甲 > 乙 > 丙 B.甲 = 乙 = 丙 C.乙 > 甲 > 丙 D.甲 > 丙 > 乙
【答案】
C
【解析】试题分析:反应速率的大小只能比较同一个物质的反应速率,可以把甲、乙、丙都转换为同一个物质的反应速率,全部转化为H2的化学反应速率,又知道化学反应速率之比等于计量系数之比,N2+3H2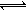 2NH3,所以乙中的v(H2):v(N2)=3:1, v(H2)=6 mol·(L·min)-1,丙中的v(H2):v(NH3)=3:2,v(H2)=1.5mol·(L·min)-1,可得到结论:乙>甲>丙。
2NH3,所以乙中的v(H2):v(N2)=3:1, v(H2)=6 mol·(L·min)-1,丙中的v(H2):v(NH3)=3:2,v(H2)=1.5mol·(L·min)-1,可得到结论:乙>甲>丙。
考点:化学反应速率的大小的比较
点评:在比较化学反应速率的快慢的时候,必须把所有的反应速率都转化为同一种物质的的反应速率,同时还要注意单位。

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.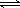 2NH3
△H =-92.4 kJ/mol,开始他们将N2和H2混合气体20mol
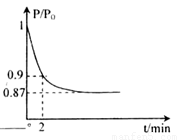
(体积比1:1)充入5L合成塔中.反应前压强为P0,反应过程中压强用P表示,反应过程中P/P0与时间t的关系如图所示。请回答下列问题:
2NH3
△H =-92.4 kJ/mol,开始他们将N2和H2混合气体20mol
(体积比1:1)充入5L合成塔中.反应前压强为P0,反应过程中压强用P表示,反应过程中P/P0与时间t的关系如图所示。请回答下列问题: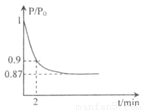
 O2(g)=CO2(g)
△H2=b kJ·mol-1
O2(g)=CO2(g)
△H2=b kJ·mol-1 2NH3(g) △H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中。反应前压强为P0,反应过程中压强用P表示,反应过程中
2NH3(g) △H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中。反应前压强为P0,反应过程中压强用P表示,反应过程中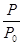 与时间t的关系如图所示。
与时间t的关系如图所示。