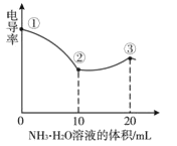
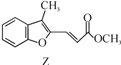
题目内容
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生如下反应:PCl5(g)PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | t2 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ<容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol/(L·s)
mol/(L·s)
D.起始时向容器Ⅲ中充入PCl5 0.30mol、PCl3 0.45 mol和Cl2 0.15 mol,则反应将向逆反应方向进行
【答案】BD
【解析】
A.I、Ⅱ温度相同,则二者平衡常数相等,Ⅲ比I相比温度升高,平衡时Ⅲ中PCl3比I中的大,说明升高温度平衡正向移动,平衡常数增大,故平衡常数K:容器Ⅱ<容器Ⅲ,故A错误;
B.恒温恒容下,Ⅱ等效在I中平衡基础上压强增大一倍,平衡逆向移动,转化率减小,PCl5的转化率:容器Ⅱ<容器Ⅰ,故B正确;
C.速率之比等于化学计量数之比,则v(PCl5)=v(PCl3)=![]() =
=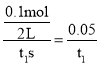 mol/(Ls),故C错误;
mol/(Ls),故C错误;
D.410℃平衡时PCl5为0.4mol0.15mol=0.25mol,该温度下平衡常数K= =0.045,浓度商Qc=
=0.045,浓度商Qc=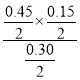 =0.1125>K=0.045,反应向逆反应进行,故D正确;
=0.1125>K=0.045,反应向逆反应进行,故D正确;
答案选BD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】实验室用硼镁泥为原料制取MgSO4·7H2O粗产品的过程如下:
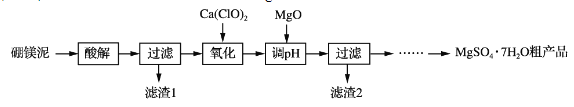
硼镁泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
(1)“酸解”时为提高Mg2+的浸出率,可采用的措施是_____(写一种)。所加酸不宜过量太多的原因是_____。
(2)“氧化”步骤中,若用H2O2代替Ca(ClO)2,则发生反应的离子方程式为______________。实际未使用H2O2,除H2O2成本高外,还可能的原因是______________________________________。
(3)“调pH”时用MgO而不用NaOH溶液的原因是________________________。
(4)结合附表信息,由MgSO4·7H2O粗产品(含少量CaSO4)提纯获取MgSO4·7H2O的实验方案如下:将粗产品溶于水,_________________________________________________,室温下自然挥发干燥。(实验中必须使用的试剂有:饱和MgSO4溶液,乙醇)附:两种盐的溶解度(g/100 g水)
温度℃ | 10 | 30 | 40 | 50 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 |