题目内容
10.25℃时,将某一元酸HA和NaOH溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如表:| 实验编号 | 起始浓度/mol•L | 反应后溶液的pH | |
| c(HA) | c(NaOH) | ||
| ① | 0.10 | 0.10 | 9 |
| ② | X | 0.05 | 7 |
| A. | X>0.05 | |
| B. | 将实验①所得溶液加水稀释后,c(OHˉ )/c(A-)变大 | |
| C. | 实验①所得溶液c(A-)+c(HA)=0.10mol•L-1 | |
| D. | 实验②所得溶液:c(Na+)+c(OH-)=c(A-)+c(H+) |
分析 结合表中数据可知:①中等浓度的HA为氢氧化钠溶液等体积混合后恰好反应生成NaA,溶液的pH=9,说明HA为弱酸,反应生成了强碱弱酸盐;
A.②中当X=0.05时,反应后的溶液显示碱性,若要为中性,则加入的HA应该稍过量,即X>0.05;
B.将实验①所得溶液加水稀释后,A-的水解程度增大,则溶液中氢氧根离子的物质的量增大、A-的物质的量减小,在同一溶液中,则c(OH-)/c(A-)变大;
C.物料守恒:c(A-)+c(HA)=c(Na+)=0.05mol•L-1;
D.混合液中满足电荷守恒:c(Na+)+c(OH-)=c(A-)+c(H+).
解答 解:根据表中实验①的数据可知:等浓度、等体积的HA为氢氧化钠溶液混合后恰好反应生成NaA,溶液的pH=9,说明HA为弱酸,反应生成了强碱弱酸盐,
A.HA为弱酸,当X=0.05时,反应后恰好生成NaA溶液,溶液显示碱性,若要使溶液变为中性,则加入的HA应该稍过量,即X>0.05,故A正确;
B.将实验①所得溶液加水稀释后,溶液中A-的水解程度增大,则溶液中氢氧根离子的物质的量增大、A-的物质的量减小,由于在同一溶液中,则c(OH-)/c(A-)的比值会变大,故B正确;
C.混合液中存在物料守恒,根据物料守恒可得:c(A-)+c(HA)=c(Na+)=0.05mol•L-1,故C错误;
D.根据混合液中的电荷守恒可得:c(Na+)+c(OH-)=c(A-)+c(H+),故D正确;
故选C.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,根据标准数据正确判断HA为弱电解质为解答关键,C为易错点,注意混合液体积增大为原先的2倍,溶液中钠离子浓度变为原先的一半.

练习册系列答案
相关题目
20.下列比较中不正确的是( )
| A. | 离子半径:Cl->F->Na+ | B. | 热稳定性:HCl>H2S>HF | ||
| C. | 酸性:HClO4>H2SO4>H2CO3 | D. | 熔点:金刚石>晶体硅>CO2 |
1.如图为锌铜显示原电池装置图,下列说法不正确( )


| A. | 电子由Zn极流向Cu极 | |
| B. | 该装置的总反应Zn+Cu2+═Zn2++Cu | |
| C. | 一段时间后,A池带正电荷,B池带负电荷 | |
| D. | 取出盐桥,电流计指针不再偏转 |
18.下列说法正确的是( )
| A. | 室温下,在水中的溶解度:丙烷>乙二醇>乙醇 | |
| B. | 可用碘水和银氨溶液鉴别葡萄糖、麦芽糖和淀粉三种物质 | |
| C. | 油脂和蛋白质均为能发生水解反应的高分子化合物 | |
| D. | 聚碳酸酯 中含有 中含有 结构 结构 |
5.HF气体分子间容易缔合.某HF气体由HF、(HF)2、(HF)3三者混合而成,其平均相对分子质量为42,则(HF)3的体积分数可能为( )
| A. | 51% | B. | 56% | C. | 49% | D. | 10% |
15.下列说法正确的是( )
| A. | NaHSO4溶液中,c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 室温时水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量共存 | |
| C. | 等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为:②>④>③>① | |
| D. | 在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大值时发生反应的离子方程式:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓ |
2.下列物质性质与应用对应关系正确的是( )
| A. | 浓硫酸具有脱水性,可用于干燥CO2 | |
| B. | 氨气具有还原性,可用于检查HCl泄漏 | |
| C. | 四氯化碳密度比水大,可用于萃取溴水中的Br2 | |
| D. | 氧化铝具有高熔点,可用于生产耐火砖 |
 ,反应类型为加聚反应.
,反应类型为加聚反应.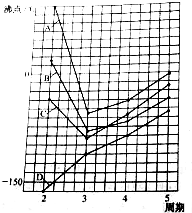 图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素气态氢化物的沸点.其中表示ⅥA族元素气态氢化物沸点的是曲线A,表示ⅣA族元素气态氢化物沸点的是曲线D;同一族中第4、5周期元素气态氢化物的沸点明显高于第3周期元素气态氢化物的沸点,其原因是同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.
图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素气态氢化物的沸点.其中表示ⅥA族元素气态氢化物沸点的是曲线A,表示ⅣA族元素气态氢化物沸点的是曲线D;同一族中第4、5周期元素气态氢化物的沸点明显高于第3周期元素气态氢化物的沸点,其原因是同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.