题目内容
【题目】等量的苛性钠溶液分别用pH=2和pH=3的醋酸溶液中和,设消耗的醋酸溶液的体积依次为Va、Vb, 则两者的关系正确的为
A. Va >10 Vb B. Vb>10 Va C. Vb<10 Va D. Vb =10Va
【答案】B
【解析】
发生中和反应NaOH+CH3COOH=CH3COONa+H2O,因为是等量的NaOH,所以中和消耗的CH3COOH的物质的量(设为n0)相等,pH=2醋酸中c(H+)=10-2mol/L,pH=3醋酸中c(H+)=10-3mol/L,将pH=2的醋酸稀释10倍时得到的醋酸溶液中c(H+)>10-3mol/L,所以pH=2的醋酸稀释超过10倍才能够得到pH=3的醋酸,设pH=2的醋酸的初始浓度为c1,pH=3的醋酸的初始浓度为c2,则![]() ,
,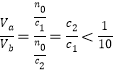 ,即Vb>10Va,答案选B。
,即Vb>10Va,答案选B。

练习册系列答案
相关题目