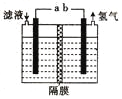
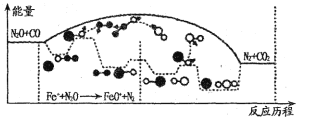
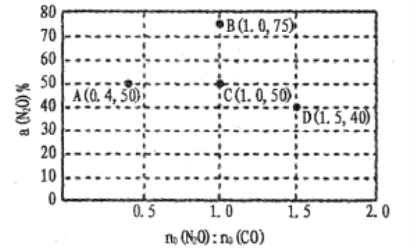
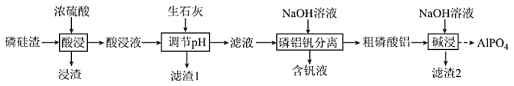
题目内容
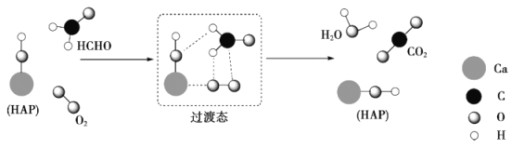
【题目】我国科学家研制出一种能在室温下高效催化空气中的甲醛氧化的催化剂,其反应如下:HCHO+O2 ![]() CO2+H2O。下列有关说法正确的是( )
CO2+H2O。下列有关说法正确的是( )
A.反应物和生成物都是非极性分子
B.HCHO 的空间构型为四面体形
C.HCHO、CO2 分子的中心原子的杂化类型不同
D.液态水中只存在一种作用力
【答案】C
【解析】
A.反应物中甲醛为极性分子、氧气为非极性分子,产物中二氧化碳为非极性分子、水为极性分子,故A错误;
B.甲醛中碳原子采取sp2杂化,则分子的空间构型为平面三角形,故B错误;
C.甲醛中碳原子采取sp2杂化,CO2分子中C原子的价层电子对数为2,其杂化类型为sp杂化,故C正确;
D.液态水中存在分子间作用力、氢键和共价键,故D错误;
故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
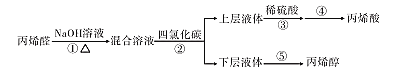
小学生10分钟应用题系列答案【题目】丙烯酸酯类物质广泛用于建筑、包装材料等,丙烯酸是合成丙烯酸酯的原料之一。丙烯醇可用于生产甘油、塑料等。以丙烯醛为原料生产丙烯醇、丙烯酸的流程如图所示:
已知:
①2CH2=CH-CHO+NaOH![]() CH2=CHCH2OH+CH2=CHCOONa
CH2=CHCH2OH+CH2=CHCOONa
②2CH2=CHOONa+H2SO4→2CH2=CHCOOH+Na2SO4
③有关物质的相关性质如表:
物质 | 丙烯醛 | 丙烯醇 | 丙烯酸 | 四氯化碳 |
沸点/℃ | 53 | 97 | 141 | 77 |
熔点/℃ | - 87 | - 129 | 13 | -22.8 |
密度/g·mL-3 | 0.84 | 0.85 | 1.02 | 1.58 |
溶解性(常温) | 易溶于水和有机溶剂 | 溶于水和有机溶剂 | 溶于水和有机溶剂 | 难溶于水 |
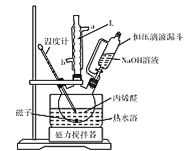
(1)操作①需要连续加热30min,所用装置如图所示。仪器L名称是________。
(2)操作②使用的主要仪器是分液漏斗,在使用之前需进行的操作是 ___。
(3)操作④包括____、过滤、冰水洗涤、低温吸干。
(4)操作⑤中,加热蒸馏“下层液体”,分离出四氯化碳;再分离出丙烯醇(如图),要得到丙烯醇应收集 ____(填温度)的馏分。图中有一处明显错误,应改为____。
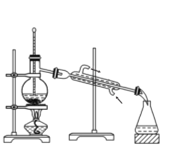
(5)测定丙烯醇的摩尔质量:准确量取amL丙烯醇于分液漏斗中,烧瓶内盛装足量钠粒。实验前量气管B中读数为b mL,当丙烯醇完全反应后,冷却至室温、调平B、C液面,量气管B的读数为c mL。已知室温下气体摩尔体积为VL·mol-1。
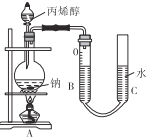
调平B、C液面的操作是____;实验测得丙烯醇的摩尔质量为____g·mol-1(用代数式表示)。如果读数时C管液面高于B管,测得结果将____(填“偏大”“偏小”或“不变”)。
【题目】某温度下,向4.0 L恒容密闭容器中充入2.0 mol PCl5,反应PCl5(g) ![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是( )
A.反应在前50 s的平均反应速率为v(PCl3)=0.006 4 mol/(L·s)
B.相同温度下,起始时向该容器中充入4.0 mol PCl3、4.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
C.相同温度下,起始时向该容器中充入2.0 mol PCl5、0.4 mol PCl3和0.40 mol Cl2,达到平衡前v(正)>v(逆)
D.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则反应的ΔH<0