题目内容
【题目】用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是( )
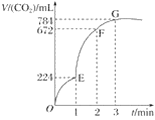
A. OE段表示的平均速率最快
B. EF段,用盐酸表示该反应的平均反应速率为0.04 mol·L-1·min-1
C. OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7
D. G点表示收集的CO2的量最多
【答案】D
【解析】
A.斜率表示反应速率,斜率越大反应速率越大,由图可知,EF段斜率最大,所以EF段反应速率最大,错误;
B.由图可知EF段生成的二氧化碳的体积为672ml-224ml=448ml,所以二氧化碳的物质的量为n(CO2)=0.448L÷22.4L/mol=0.02mol,根据CaCO3+2HCl═CaCl2+CO2↑+H2O,可知参加反应的氯化氢的物质的量为0.04mol,所以盐酸的浓度变化量为Δc=![]() ,则EF段用盐酸表示该反应的平均反应速率为V(HCl)=
,则EF段用盐酸表示该反应的平均反应速率为V(HCl)=![]() ,错误;
,错误;
C.OE、EF、FG三段生成的二氧化碳体积分别为224ml、448ml、112ml,所以OE、EF、FG三段中,该反应用CO2表示的平均反应速率之比为224ml:448ml:112ml=2:4:1,错误;
D.G点表示收集的二氧化碳为从开始到G点生成的二氧化碳,总共784ml,正确。
故合理选项是D。

【题目】有a、b、c、d四个金属电极,G为电流计。有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小、b极质量增加 | 溶液中的SO42-向b极移动 | d极溶解c极有气体产生 | 电子从d极流向a极 |
由此可判断这四种金属的活动性顺序是
A. d>a>b>cB. a>b>c>dC. b>c>d>aD. a>b>d>c
【题目】某化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液的组成进行探究,取20.0mL该混合溶液,向其中不断加入1.00mol·L﹣1的稀盐酸,加入稀盐酸的体积和产生的现象如表中所示.
反应阶段 | Ⅰ | Ⅱ | Ⅲ |
稀盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
现 象 | 无气体 | 有气体 | 无气体 |
则混合溶液中c(HCO3﹣)为( )
A. 1.00mol·L﹣1 B. 0.50mol·L﹣1 C. 1.50mol·L﹣1 D. 2.00mol·L﹣1