题目内容
(8分)现有MgO和Al2O3的固体混合物,向其中加入100 mL 2 moL·L-1稀盐酸,充分反应后向溶液中逐滴加入 1 moL·L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图:(已知MgO为碱性氧化物)

⑴NaOH溶液加至220 ml 时溶液中含有的金属元素的离子有 。
⑵混合物中,MgO与Al2O3的物质的量之比为 。
⑶根据以上所给数据求出 x = 。

⑴NaOH溶液加至220 ml 时溶液中含有的金属元素的离子有 。
⑵混合物中,MgO与Al2O3的物质的量之比为 。
⑶根据以上所给数据求出 x = 。
(1)Na+、AlO2— (2)6︰1 (3)200
试题分析:(1)氧化镁和氧化铝分别和盐酸反应生成氯化镁、氯化铝。然后加入氢氧化钠,根据图像可知,盐酸是过量的,其中20ml氢氧化钠和过量的盐酸反应。但沉淀达到最大值时,继续加入氢氧化钠,则沉淀氢氧化铝开始溶解生成偏铝酸钠,所以NaOH溶液加至220 ml 时溶液中含有的金属元素的离子有Na+、AlO2—。
(2)根据坐标可知,氢氧化铝的物质的量是0.08mol-0.06mol=0.02mol,则根据方程式Al(OH)3+NaOH=NaAlO2+2H2O可知,消耗氢氧化钠是0.02mol,其体积是20ml,所以X=200ml。根据方程式AlCl3+3NaOH=Al(OH)3↓+3NaCl可知,生成氢氧化铝消耗的氢氧化钠体积是60ml,所以和氯化镁反应的氢氧化钠是200ml-60ml-20ml=120ml,物质的量是0.12mol,则氯化镁的物质的量是0.06mol,所以根据原子守恒可知,MgO与Al2O3的物质的量之比为0.06︰0.01=6︰1。
点评:该题是中等难度的试题,试题贴近高考,结合图像分析,增加了试题的难度。试题注重考查学生的解题能力,特别是分析问题、解决问题的能力。该题有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率。

练习册系列答案
相关题目
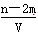 mol·L-1
mol·L-1  mol·L-1
mol·L-1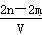 mol·L-1
mol·L-1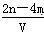 mol·L-1
mol·L-1