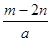题目内容
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
| A.100mL 0.1mol·L-1的稀硫酸中含有SO42-个数为0.1NA |
| B.1 mol大米中含有NA个大米粒子 |
| C.2.7g金属铝与足量的盐酸反应,铝失去电子数为0.3NA |
| D.常温常压下,11.2L甲烷所含的分子数为0.5NA |
C
试题分析:A项:应为0.01NA,故错;B项:大米是宏观物质,故错;D项:气体摩尔体积不明确,无法计算,故错。故选C。
点评:本题考查了阿伏伽德罗常数的应用,主要考查质量、物质的量、微粒数、气体体积和浓度之间的换算。另外需要注意的是阿佛加德罗常数的计量对象是微观粒子。

练习册系列答案
相关题目
 的物质的量浓度之比为 ( )
的物质的量浓度之比为 ( )