题目内容
下列变化不能用勒夏特列原理解释的是( )
| A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
B.已知反应 H2(g)+ I2(g) 2HI(g)达平衡, 加压后混合气体颜色变深 2HI(g)达平衡, 加压后混合气体颜色变深 |
| C.红棕色的NO2加压后颜色先变深再变浅 |
| D.实验室用排饱和食盐水的方法收集氯气 |
B
解析试题分析:A.在工业上制取硫酸的关键反应是2SO2+O2 2SO3。由于该反应是可能反应。若使用过量的氧气,即增大了氧气的浓度,关键平衡移动原理:增大反应物的浓度,平衡正向移动,可以使更多的SO2转化为SO3。因此二氧化硫的转化率提高。正确。B. 已知反应 H2(g)+ I2(g)
2SO3。由于该反应是可能反应。若使用过量的氧气,即增大了氧气的浓度,关键平衡移动原理:增大反应物的浓度,平衡正向移动,可以使更多的SO2转化为SO3。因此二氧化硫的转化率提高。正确。B. 已知反应 H2(g)+ I2(g) 2HI(g)达平衡,由于该反应是反应前后气体体积相等的可能反应。加压平衡不发生移动。但是由于加压后单位体积内的I2的物质的量增大,所以浓度增大,混合气体颜色变深。正确。C.在密闭容器内NO2存在化学平衡:2NO2(g)
2HI(g)达平衡,由于该反应是反应前后气体体积相等的可能反应。加压平衡不发生移动。但是由于加压后单位体积内的I2的物质的量增大,所以浓度增大,混合气体颜色变深。正确。C.在密闭容器内NO2存在化学平衡:2NO2(g) N2O4(g)NO2是红棕色的气体,N2O4是无色气体。加压后单位体积内NO2增多,所以气体的颜色先变深。由于该反应的正反应是气体体积减小的反应。增大压强,化学平衡向正反应方向移动,所以气体的颜色又逐渐变浅。但是颜色比加压前深。正确。D.氯气在水中存在化学平衡:Cl2+H2O
N2O4(g)NO2是红棕色的气体,N2O4是无色气体。加压后单位体积内NO2增多,所以气体的颜色先变深。由于该反应的正反应是气体体积减小的反应。增大压强,化学平衡向正反应方向移动,所以气体的颜色又逐渐变浅。但是颜色比加压前深。正确。D.氯气在水中存在化学平衡:Cl2+H2O H++Cl-+HclO。若水中存在NaCl。则食盐电离产生的Cl-会使c(Cl-)增大。根据平衡移动原理:增大生成物的浓度,平衡向逆反应方向移动。因此可以减小氯气在水中的溶解和反应而引起的消耗。故实验室用排饱和食盐水的方法收集氯气。正确。
H++Cl-+HclO。若水中存在NaCl。则食盐电离产生的Cl-会使c(Cl-)增大。根据平衡移动原理:增大生成物的浓度,平衡向逆反应方向移动。因此可以减小氯气在水中的溶解和反应而引起的消耗。故实验室用排饱和食盐水的方法收集氯气。正确。
考点:考查勒夏特列原理在实验室制取气体、工业上制取硫酸及一些现象的解释中应用的知识。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案升高温度时,化学反应速率加快,主要原因是( )
| A.分子运动速率加快,使该反应物分子的碰撞机会增多 |
| B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
| C.该化学反应的过程是吸热的 |
| D.该化学反应的过程是放热的 |
在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g) 3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是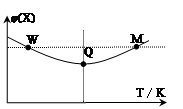
| A.升高温度,平衡常数增大 |
| B.W点X的正反应速率等于M点X的正反应速率 |
| C.Q点时,Y的转化率最大 |
| D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大 |
一定条件下的密闭容器中:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是( )
4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是( )
| A.4 mol NH3和5 mol O2反应,达到平衡时放出的热量为905.9 kJ |
B.平衡时v正(O2)=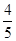 v逆(NO) v逆(NO) |
| C.平衡后降低压强,混合气体平均摩尔质量增大 |
| D.平衡后升高温度,混合气体中NO含量降低 |
在容积可变的密闭容器中,2 mol N2和8 mol H2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时氮气的体积分数接近于( )
| A.5% | B.10% | C.15% | D.20% |
高温下,某反应达平衡,平衡常数K=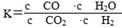 ,恒容时,温度升高,H2浓度减小。下列说法正确的是( )
,恒容时,温度升高,H2浓度减小。下列说法正确的是( )
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为CO+H2O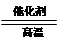 CO2+H2 CO2+H2 |
已知:2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol·L-1) | 0.8 | 1.24 | 1.24 |
下列说法正确的是( )
①平衡后升高温度,平衡常数>400
②平衡时,c(CH3OCH3)=1.6 mol/L
③平衡时,反应混合物的总能量减少20 kJ
④平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
⑤此时刻反应达到平衡状态
⑥平衡时CH3OH的浓度为0.08 mol·L-1
A.①②④⑤ B.②⑥ C.②③④⑥ D.②④⑥
已知反应:A(g)+3B(g) 2C(g)是放热反应,达到平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
2C(g)是放热反应,达到平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
| A.正反应速率增大,逆反应速率变小,平衡向正反应方向移动 |
| B.正反应速率变小,逆反应速率增大,平衡向逆反应方向移动 |
| C.正反应速率和逆反应速率都变小,平衡向正反应方向移动 |
| D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动 |