题目内容
(7分)已知3Cu+8HNO3==3Cu(NO3)2+2NO+4H2O
(1)该反应的还原产物是 。
(2)将化学方程式改写成离子方程式。
若有6mole-发生转移,则
(3)被氧化的铜的物质的量为 。
(4)被还原的硝酸的质量是 。
(5)生成的NO在标准状况下的体积为 。.
(6) 已知硝酸溶液的体积为2L,硝酸全部参与反应,则该硝酸的物质的量浓度为 。
(1)该反应的还原产物是 。
(2)将化学方程式改写成离子方程式。
若有6mole-发生转移,则
(3)被氧化的铜的物质的量为 。
(4)被还原的硝酸的质量是 。
(5)生成的NO在标准状况下的体积为 。.
(6) 已知硝酸溶液的体积为2L,硝酸全部参与反应,则该硝酸的物质的量浓度为 。
(1) NO (2)3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O
(3)3mol (4)126g (5)44.8L (6)4mol/L(2分)
(3)3mol (4)126g (5)44.8L (6)4mol/L(2分)
(1)氧化剂被含有生成还原产物。硝酸是氧化剂,所以NO是还原产物。
(2)硝酸和硝酸铜属于强电解质,属于反应的离子方程式为
3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O。
(3)根据方程式可知每消耗3mol铜就转移6mol电子,所以若有6mole-发生转移时被氧化的铜是3mol。还原产物是2molNO,所以被还原的硝酸是2mol,质量是2mol×63g/mol=126g。生成的NO是2mol,体积是2mol×22.4L/mol=44.8L。参加反应的硝酸是8mol,所以浓度是 .
.
(2)硝酸和硝酸铜属于强电解质,属于反应的离子方程式为
3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O。
(3)根据方程式可知每消耗3mol铜就转移6mol电子,所以若有6mole-发生转移时被氧化的铜是3mol。还原产物是2molNO,所以被还原的硝酸是2mol,质量是2mol×63g/mol=126g。生成的NO是2mol,体积是2mol×22.4L/mol=44.8L。参加反应的硝酸是8mol,所以浓度是
 .
.
练习册系列答案
相关题目

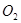 ,恰好使气体完全溶于水。则通入
,恰好使气体完全溶于水。则通入