题目内容
(10分)将2.56g金属铜投入到一定物质的量浓度的浓硝酸中,生成气体颜色越来越浅,当恰好完全反应时,共收集到标准状况下896mL气体。
(1)、写出可能发生反应的化学方程式
____________________________________________________________
_____________________________________________________________
(2)、计算参加反应的硝酸的物质的量是多少?(3分)
(3)将盛有生成气体的容器倒扣在水槽中,通入标准状况下一定体积的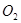 ,恰好使气体完全溶于水。则通入
,恰好使气体完全溶于水。则通入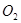 的体积为多少?(3分)
的体积为多少?(3分)
(1)、写出可能发生反应的化学方程式
____________________________________________________________
_____________________________________________________________
(2)、计算参加反应的硝酸的物质的量是多少?(3分)
(3)将盛有生成气体的容器倒扣在水槽中,通入标准状况下一定体积的
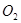 ,恰好使气体完全溶于水。则通入
,恰好使气体完全溶于水。则通入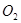 的体积为多少?(3分)
的体积为多少?(3分)(1) Cu + 4HNO3=Cu(NO3)2 + NO2↑ + 2H2O(2分)
3Cu +8HNO3 =Cu(NO3)2 + 2NO↑ + 4H2O(2分)
(2) 0.12mol(3)0.448L
3Cu +8HNO3 =Cu(NO3)2 + 2NO↑ + 4H2O(2分)
(2) 0.12mol(3)0.448L
考查硝酸的化学性质,硝酸越浓氧化性越强。在反应过程中由于不断的消耗硝酸,使其浓度逐渐降低,所以还原产物中既有NO2,又有NO生成,方程式为Cu + 4HNO3=Cu(NO3)2 + NO2↑ + 2H2O、3Cu +8HNO3=Cu(NO3)2 + 2NO↑ + 4H2O。因为是氧化还原反应,所以可以利用得失电子守恒以及原子守恒来进行计算。
(2) 2.56g金属铜是 ,则生成硝酸铜是0.04mol,所以没有被还原的硝酸是0.08mol。被还原的硝酸是
,则生成硝酸铜是0.04mol,所以没有被还原的硝酸是0.08mol。被还原的硝酸是 ,因此根据原子守恒可知硝酸的物质的量是0.08mol+0.04mol=0.12mol。
,因此根据原子守恒可知硝酸的物质的量是0.08mol+0.04mol=0.12mol。
(3)金属铜一共失去电子是0.04mol×2=0.08mol,因为通入的氧气又把NO和NO2氧化生成硝酸,所以氧气所得电子就相当于是铜所失去的电子,根据得失电子守恒可知,氧气的物质的量是0.02mol,在标准状况下的体积是0.02mol×22.4L/mol=0.448L。
(2) 2.56g金属铜是
 ,则生成硝酸铜是0.04mol,所以没有被还原的硝酸是0.08mol。被还原的硝酸是
,则生成硝酸铜是0.04mol,所以没有被还原的硝酸是0.08mol。被还原的硝酸是 ,因此根据原子守恒可知硝酸的物质的量是0.08mol+0.04mol=0.12mol。
,因此根据原子守恒可知硝酸的物质的量是0.08mol+0.04mol=0.12mol。(3)金属铜一共失去电子是0.04mol×2=0.08mol,因为通入的氧气又把NO和NO2氧化生成硝酸,所以氧气所得电子就相当于是铜所失去的电子,根据得失电子守恒可知,氧气的物质的量是0.02mol,在标准状况下的体积是0.02mol×22.4L/mol=0.448L。

练习册系列答案
相关题目