题目内容
【题目】如图是某课外小组制取乙炔并测定乙炔的某些性质的实验. 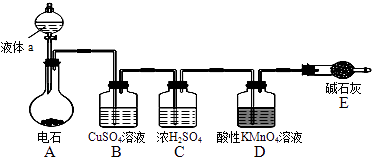
(1)写出实验室制取乙炔的化学方程式: .
(2)实验室制取乙炔时,分液漏斗中的液体a通常是 .
(3)CuSO4溶液的作用是 .
(4)装置D中的现象是: .
(5)工业上常用乙炔、饱和食盐水等物质作原料来合成聚氯乙烯,请写出相关方程式:
; ; ; .
【答案】
(1)CaC2+2H2O→Ca(OH)2+C2H2↑
(2)饱和食盐水
(3)吸收杂质气体硫化氢
(4)高锰酸钾溶液褪色
(5)2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑| Cl2+H2=2HCl| C2H2+HCl→CH2=CHCl| nCH2=CHCl→
2NaOH+Cl2↑+H2↑| Cl2+H2=2HCl| C2H2+HCl→CH2=CHCl| nCH2=CHCl→![]()
【解析】解:(1.)电石与水反应生成乙炔和氢氧化钙,化学反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑,所以答案是:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2.)电石与水反应速率太快,通常利用饱和食盐水代替水以减慢化学反应速率,所以答案是:饱和食盐水;
(3.)此反应中会产生杂质气体,硫化氢、磷化氢,会对乙炔性质实验造成干扰,利用硫酸铜溶液吸收硫化氢气体,以避免干扰,所以答案是:吸收杂质气体硫化氢;
(4.)乙炔含有碳碳三键,能与高锰酸钾溶液反应使其褪色,所以答案是:高锰酸钾溶液褪色;
(5.)聚氯乙烯的单体是氯乙烯,饱和食盐水的作用是电解制取氯气,化学反应方程式为:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑,Cl2+H2=2HCl,C2H2+HCl→CH2=CHCl,氯乙烯加聚反应生成聚氯乙烯:nCH2=CHCl→
2NaOH+Cl2↑+H2↑,Cl2+H2=2HCl,C2H2+HCl→CH2=CHCl,氯乙烯加聚反应生成聚氯乙烯:nCH2=CHCl→![]() , 所以答案是:2NaCl+2H2O
, 所以答案是:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑、Cl2+H2=2HCl、C2H2+HCl→CH2=CHCl、nCH2=CHCl→
2NaOH+Cl2↑+H2↑、Cl2+H2=2HCl、C2H2+HCl→CH2=CHCl、nCH2=CHCl→![]() .
.